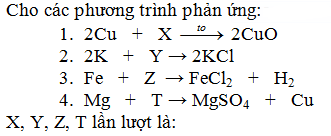Câu hỏi:
2 năm trước
Cho 1,08 gam kim loại R vào dung dịch H2SO4 loãng dư. Lọc dung dịch, đem cô cạn thu được 6,84 gam một muối khan duy nhất. Kim loại R là:
Trả lời bởi giáo viên
Đáp án đúng: c
Gọi kim loại R có hóa trị n (n = 1, 2, 3, 4)
2R + nH2SO4 → R2(SO4)n + nH2
Ta có: ${n_R} = \frac{{1,08}}{R}\,\,mol;\,\,{n_{{R_2}{{(S{O_4})}_n}}} = \frac{{6,84}}{{2{\text{R}} + 96n}}\,\,mol$
Theo phản ứng: ${n_R} = 2.\,\,{n_{{R_2}{{(S{O_4})}_n}}} = > \frac{{1,08}}{R} = 2.\frac{{6,84}}{{2{\text{R}} + 96n}}\,$
=> R = 9n
Ta có bảng sau:

Vậy R là kim loại Al
Hướng dẫn giải:
+) 2R + nH2SO4 → R2(SO4)n + nH2
+) ${n_R} = 2.\,\,{n_{{R_2}{{(S{O_4})}_n}}} = > \frac{{1,08}}{R} = 2.\frac{{6,84}}{{2{\text{R}} + 96n}}\,$