Dạng 1
Lý thuyết về cacbon
* Một số lưu ý cần nhớ:
- 1. Vị trí:
Trong bảng tuần hoàn cacbon ở ô thứ 6, nhóm IVA, chu kì 2. Cấu hình electron : 1s22s22p2
2. Tính chất vật lý:
Cacbon tạo thành một số dạng thù hình: kim cương, than chì, fuleren, cacbon vô định hình. Các dạng này khác nhau về tính chất vật lí do khác nhau về cấu trúc tinh thể và khả năng liên kết nên ứng dụng cũng khác nhau.
3. Tính chất hóa học:
* Tính khử:
- Tác dụng với oxi:
C + O2 \(\xrightarrow{{{t}^{o}}}\) CO2
- Tác dụng với hợp chất:
C + 2H2SO4 (đặc) \(\xrightarrow{{{t}^{o}}}\) CO2 + 2SO2 + 2H2O
* Tính OXH:
- Tác dụng với hidro:
C + 2H2 \(\xrightarrow{Ni,\,\,{{500}^{o}}C}\) CH4
- Tác dụng với KL:
Ca + 2C \(\xrightarrow{{{t}^{o}}}\) CaC2
4Al + 3C \(\xrightarrow{{{t}^{o}}}\) Al4C3
* Một số ví dụ điển hình
Ví dụ 1: Kim cương, fuleren và than chì là các dạng:
A. đồng hình của cacbon.
B. đồng vị của cacbon.
C. thù hình của cacbon.
D. đồng phân của cacbon.
Hướng dẫn giải chi tiết:
Kim cương, fuleren và than chì là các dạng thù hình của cacbon.
Đáp án C
Câu 2: Thuốc nổ đen là hỗn hợp
A. KNO3, C và S.
B. KNO3 và S.
C. KClO3, C và S.
D. KClO3 và S.
Hướng dẫn giải chi tiết:
Thuốc nổ đen là hỗn hợp gồm KNO3, C và S.
Đáp án A
Câu 3: Cho các chất: O2 (1), CO2 (2), H2 (3), Fe2O3 (4), SiO2 (5), HCl (6), CaO (7), H2SO4 đặc (8), HNO3 (9), H2O (10), KCl (11). Cacbon phản ứng trực tiếp được với bao nhiêu chất?
A. 8
B. 9
C. 7
D. 10
Hướng dẫn giải chi tiết:
C phản ứng trực tiếp được với các chất: O2, CO2, H2, Fe2O3, H2SO4 đặc, HNO3, H2O
Đáp án C
Câu 4: Tính khử của cacbon thể hiện ở phản ứng nào trong các phản ứng sau:
A. \(C+ZnO\xrightarrow{{{t}^{0}}}Zn+CO\)
B. \(C+2{{H}_{2}}\xrightarrow{t,xt}C{{H}_{4}}\)
C. \(2C+\,Ca\xrightarrow{{{t}^{0}}}Ca{{C}_{2}}\)
D. \(3C+\,4Al\xrightarrow{{{t}^{0}}}A{{l}_{4}}{{C}_{3}}\)
Hướng dẫn giải chi tiết:
C thể hiện tính khử khi tác dụng với các chất có tính oxi hóa như : CO2; ZnO (các oxit sau Al); HNO3 (đặc); H2SO4 (đặc)
Đáp án A
Câu 5: Đốt cháy hỗn hợp lưu huỳnh và cacbon (thể tích không đáng kể) trong bình kín đựng oxi dư, thu được hỗn hợp ba khí (CO2, SO2, O2). Sau đó đưa bình về nhiệt độ ban đầu thì áp suất trong bình so với trước khi đốt sẽ thay đổi như thế nào?
A. Tăng
B. Gỉam
C. Có thể tăng hoặc giảm (phụ thuộc vào lượng S, C)
D. Không đổi
Hướng dẫn giải chi tiết:
S(rắn) + O2 \(\xrightarrow{{{t^0}}}\) SO2
C(rắn) + O2 \(\xrightarrow{{{t^0}}}\) CO2
Từ 2 phương trình trên ta thấy số mol khí của chất tham gia phản ứng và sau phản ứng bằng nhau và không phụ thuộc vào lượng C, S => do vậy áp suất của bình sẽ không thay đổi khi ta đưa về nhiệt độ ban đầu
Đáp án D
Dạng 2
Bài tập về tính chất hóa học của C
(Tác dụng với nước, kim loại, oxit kim loại, …)
* Một số lưu ý cần nhớ:
Ta có phương trình tổng quát:
nC + M2On → nCO + 2M
Trong đó M là những kim loại có mức độ hoạt động trung bình, đứng sau Al
Để làm được dạng bài tập này, ta cần áp dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố và bảo toàn electron để giải
* Một số ví dụ điển hình:
Ví dụ 1: Cho 3,60 gam cacbon tác dụng với 8,10 gam nhôm. Khối lượng nhôm cacbua tạo thành nếu hiệu suất của phản ứng 70% là
A. 5,76 gam
B. 7,56 gam
C. 10,08 gam
D. 10,80 gam
Hướng dẫn giải chi tiết:
nC = 0,3 mol; nAl = 0,3 mol
3C + 4Al \(\xrightarrow{{{t}^{o}}}\) Al4C3
Xét tỉ lệ : \(\frac{{{n_C}}}{3} = \frac{{0,3}}{3} = 0,1\,\, > \,\,\frac{{{n_{Al}}}}{4} = \frac{{0,3}}{4} = 0,075\) => phản ứng tính theo Al
nAl4C3 lí thuyết = nAl / 4 = 0,075 mol
H = 70% => nAl4C3 thực tế = 0,075.70/100 = 0,0525 mol => mAl4C3 = 7,56 gam
Đáp án B
Câu 2: Thể tích khí NO2 thoát ra ở đktc khi cho 0,12 gam cacbon tác dụng hết với HNO3 đặc nguội (coi phản ứng xảy ra hoàn toàn) là
A. 0,896 lít
B. 0,672 lít
C. 0,448 lít
D. 0.336 lít
Hướng dẫn giải chi tiết:
Quá trình cho – nhận e:
\(C\,\, \to \,\,\mathop C\limits^{ + 4} \,\, + \,\,4e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} \,\, + \,\,1e\,\, \to \,\,\mathop N\limits^{ + 4} \)
0,01 → 0,04 0,04 → 0,04
=> VNO2 = 0,04.22,4 = 0,896 lít
Đáp án A
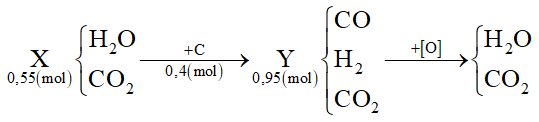
Câu 3: Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2 sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
A. 9,85
B. 19,7
C. 29,55
D. 15,76
Hướng dẫn giải chi tiết:
Ta thấy nC = nY - nX = 0,95 - 0,55 = 0,4 mol
Oxi hóa hoàn toàn hỗn hợp Y thì:
Áp dụng bảo toàn e cho toàn bộ quá trình thì: 4nC = 2nO → nO = 0,8 mol
Mà nO = ∑nCO(Y), H2(Y) = 0,8 mol ⟹ nCO2(Y) = 0,95 - 0,8 = 0,15 mol
Khi cho Y phản ứng với Ba(OH)2 tức là 0,15 mol CO2 phản ứng với 0,1 mol Ba(OH)2:
Tỉ lệ: 1 < nOH-/nCO2 = 0,2/0,15 = 1,33 < 2 → tạo CO32- (a) và HCO3- (b)
Giải hệ: \(\left\{ \begin{array}{l}{n_{C{O_2}}} = a + b = 0,15\\{n_{O{H^ - }}} = 2{\rm{a}} + b = 0,2\end{array} \right. \to \left\{ \begin{array}{l}a = 0,05\\b = 0,1\end{array} \right.\)
Ba2+ + CO32- → BaCO3
0,05 ← 0,05 → 0,05
→ m↓ = 0,05.197 = 9,85 gam
Đáp án A
Câu 4: Trộn 20 gam bột CuO và một lượng C rồi đem nung nóng, sau một thời gian phản ứng thấy có 3,36 lít khí thoát ra khỏi bình. Khối lượng chất rắn thu được là
A. 17,6
B. 8
C. 9,6
D. 15,6
Hướng dẫn giải chi tiết:
CuO + C \(\xrightarrow{{{t}^{o}}}\) Cu + CO
nCO = 3,36 / 22,4 = 0,15 mol
=> nCuO phản ứng = 0,15 mol
=> mCuO dư = 20 – 0,15.80 = 8 gam
nCu tạo thành = nCuO phản ứng = 0,15 mol
=> mCu = 0,15.64 = 9,6 gam
=> mchất rắn sau phản ứng = 8 + 9,6 = 17,6 gam
Đáp án A