Đề bài
I. TRẮC NGHIỆM KHÁCH QUAN (6 ĐIỂM, từ câu 1 - 18)
Câu 1: Một học sinh đã điều chế và thu khí NH3 theo sơ đồ sau đây, nhưng kết quả thí nghiệm không thành công. Lí do chính là:
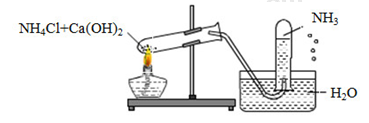
A. NH3 không được điều chế từ NH4Cl và Ca(OH)2.
B. NH3 không được thu bằng phương pháp đẩy nước mà là đẩy không khí.
C. Thí nghiệm trên xảy ra ở điều kiện thường nên không cần nhiệt độ.
D. Ống nghiệm phải để hướng xuống chứ không phải hướng lên.
Câu 2: Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của :
A. N B. K2O
C. P D. P2O5
Câu 3: Sục V lít CO2(đkc) vào 100ml dung dịch Ca(OH)2 2M thu được 10 gam kết tủa.V có giá trị là:
A. 2,24 lít hoặc 6,72 lít.
B. 2,24 lít.
C. 6,72 lít.
D. 2,24 lít hoặc 4,48 lít.
Câu 4: Hiđroxit nào sau đây không phải là hiđroxit lưỡng tính:
A. Cr(OH)3. B. Al(OH)3 .
C. Zn(OH)2. D. Ba(OH)2.
Câu 5: Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
A. 2,24 lít. B. 11,2 lít.
C. 4,48 lít. D. 6,72 lít.
Câu 6: Cho dãy các chất sau: Al, NaHCO3, (NH4)2CO3, NH4Cl, Al2O3, Zn, K2CO3, K2SO4. Có bao nhiêu chất trong dãy vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch NaOH?
A. 5. B. 2.
C. 3. D. 4.
Câu 7: Cho N (Z = 7). Cấu hình electron của Nitơ là?
A. 1s22s22p4.
B. 1s22s22p6.
C. 1s22s22p3 .
D. 1s22s22p5.
Câu 8: Photpho trắng được bảo quản bằng cách ngâm trong:
A. benzen. B. ete.
C. dầu hoả. D. nước.
Câu 9: “Nước đá khô” không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và khô rất tiện cho việc bảo quản thực phẩm. Nước đá khô là:
A. H2O rắn. B. CO2 rắn.
C. SO2 rắn. D. CO rắn.
Câu 10: Dẫn luồng khí CO qua hỗn hợp Al2O3, CuO, MgO, Fe2O3 đun nóng, sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là:
A. Al2O3, Cu, MgO, Fe .
B. Al; Fe, Cu, Mg.
C. Al2O3, Cu, Mg, Fe.
D. Al2O3, Cu, MgO, Fe2O3.
Câu 11: Khi cho quỳ tím vào dung dịch HCl 0,10M thì quỳ tím đổi sang màu:
A. vàng. B. xanh.
C. trắng. D. đỏ.
Câu 12: Phân đạm giúp cho cây phát triển nhanh, cho nhiều hạt, củ, quả. Hiện nay người ta chủ yếu sử dụng đạm urê để bón cho cây trồng. Công thức phân tử của đạm urê là:
A. NaNO3. B. (NH2)2CO.
C. NH4NO3. D. NH4Cl.
Câu 13: Một dung dịch có nồng độ [OH-] = 2,5.10-10 mol/l. Môi trường của dung dịch này là:
A. Kiềm.
B. Axit.
C. Trung tính
D. Lưỡng tính.
Câu 14: Những kim loại nào sau đây không tác dụng được với dung dịch HNO3 đặc, nguội
A. Fe, Al B. Zn, Pb
C. Mn, Ni D. Cu, Ag
Câu 15: Chất nào sau đây không dẫn điện được?
A. Nước ở hồ, nước mặn.
B. Nước biển.
C. KCl rắn, khan.
D. Dung dịch KCl trong nước.
Câu 16: Dung dịch X có chứa a mol Na+, b mol Mg2+, c mol Cl- và d mol SO42-. Biểu thức nào sau đây đúng:
A. a + b = c + d.
B. a + 2b = c + 2d.
C. a + 2b = c + d.
D. a + 2b = - c - 2d.
Câu 17: Cho từ từ dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2. Hiện tượng xảy ra là?
A. có kết tủa trắng.
B. không có hiện tượng.
C. có mùi khai bay lên và có kết tủa trắng.
D. có khí mùi khai bay lên.
Câu 18: Cho 20 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Hỏi muối nào được tạo thành? Khối lượng là bao nhiêu ?
A. Na3PO4: 50 gam.
B. Na2HPO4: 14,2 gam và Na3PO4: 49,2 gam.
C. Na3PO4: 50 gam và Na2HPO4: 22,5 gam.
D. NaH2PO4: 36 gam và Na2HPO4: 14,2 gam.
II. PHẦN TỰ LUẬN (4 điểm)
Câu 1: (2,0 điểm) Viết phương trình hóa học theo sơ đồ sau, ghi rõ điều kiện (nếu có):
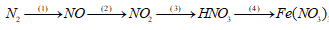
Câu 2: (2,0 điểm) Khi cho 3,32 gam hỗn hợp Fe và Cu tác dụng hoàn toàn với 400 ml dung dịch HNO3 0,5M thu được 1,008 lít khí NO duy nhất (đktc).
a) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu ?
b) Tính nồng độ mol của axit HNO3 trong dung dịch sau phản ứng ? Biết thể tích dung dịch không đổi.
Lời giải chi tiết
| 1 | 2 | 3 | 4 | 5 |
| B | D | A | D | C |
| 6 | 7 | 8 | 9 | 10 |
| A | C | D | B | A |
| 11 | 12 | 13 | 14 | 15 |
| D | B | B | A | C |
| 16 | 17 | 18 |
| |
| B | C | D | ||
Câu 1:
NH3 tan rất tốt trong nước, nên không được thu bằng phương pháp đẩy nước
Đáp án B
Câu 2:
Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của P2O5
Đáp án D
Câu 3:
n Ca(OH)2 = 0,1 .2 = 0,2 mol
n CaCO3 = 10 : 100 = 0,1 mol
* TH1
Phương trình phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
(1) n CaCO3 = n CO2 = 0,1 mol
V CO2 = 0,1 . 22,4 = 2,24 lit
* TH2
Phương trình phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O (2)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (3)
(2) n CO2 = n Ca(OH)2 = n CaCO3 = 0,1 mol
(3) n Ca(OH)2 = 0,2 – 0,1 = 0,1 mol
(3) n CO2 = 2 . n Ca(OH)2 = 0,2 mol
=> V CO2 = (0,1 + 0,2) , 22,4 = 6,72 lít
Đáp án A
Câu 4:
Đáp án D
Câu 5:
m Fe phản ứng = 20 – 3,2 = 16,8 gam
n Fe = 16,8 : 56 = 0,3 mol
Sau phản ứng Fe còn dư nên muối thu được là muối sắt (II)
Áp dụng định luật bảo toàn electron:
2 . n Fe = 3 . n NO
=> 2 .0,3 = 3 . n NO
=> n NO = 0,2 mol
V NO = 0,2 . 22,4 = 4,48 lít
Đáp án C
Câu 6:
Các chất tác dụng được với dung dịch NaOH và HCl là:
Al, NaHCO3,(NH4)2CO3, Al2O3, Zn
Đáp án A
Câu 7:
Đáp án C
Câu 8:
Photpho trắng được bảo quản bằng cách ngâm trong nước
Đáp án D
Câu 9:
Đáp án B
Câu 10:
CO khử được những oxit kim loại đứng sau Al
Đáp án A
Câu 11:
Đáp án D
Câu 12:
Đáp án B
Câu 13:
[OH-] < 10-7
=> Môi trường axit
Đáp án B
Câu 14:
Đáp án A
Câu 15:
Đáp án C
Câu 16:
Áp dụng định luật bảo toàn điện tích ta có:
a + 2b = c + 2d
Đáp án B
Câu 17:
(NH4)2SO4 + Ba(OH)2 → BaSO4 + 2NH3 + 2H2O
=> Có mùi khai bay lên (NH3) và có kết tủa trắng BaSO4
Đáp án C
Câu 18:
n NaOH = 20 : 40 = 0,5 mol
n H3PO4 = 39,2 : 98 = 0,4 mol
Ta có : n OH : n H3PO4 = 0,5 : 0,4 = 1,25
=> Sau phản ứng chất thu được là: Na2HPO4 và NaH2PO4
Ta có phương trình:
2NaOH + H3PO4 → Na2HPO4 + 2H2O (1)
NaOH + H3PO4 → NaH2PO4 + H2O (2)
Gọi số mol Na2HPO4; NaH2PO4 lần lượt là x, y
=> Ta có hệ phương trình:
x + y = 0,4
2x + y = 0,5
=> x = 0,1 mol; y = 0,3 mol
m Na2HPO4 = 0,1 . 142 = 14,2 gam
m NaH2PO4 = 0,3 . 120 = 36 gam
Đáp án D
II. TỰ LUẬN
Câu 1
(1) N2 + O2 \(\buildrel \text{tia lửa điện} \over\longrightarrow \)2NO
(2) 2NO + O2 → 2NO2
(3) 4NO2 + O2 + 2H2O → 4HNO3
(4) 6HNO3 + Fe2O3 → 2Fe(NO3)3 + 3H2O
Câu 2
nHNO3 bđ = 0,4.0,5 = 0,2 mol
nNO = 1,008/22,4 = 0,045 mol
Đặt nFe = x mol và nCu = y mol
a) Khối lượng của hỗn hợp là 3,32 gam nên ta có: 56x + 64y = 3,32 (1)
Ta có quá trình cho – nhận e:
Fe0 – 3e → Fe+3
x → 3x (mol)
Cu0 – 2e → Cu+2
y → 2y (mol)
N+5 + 3e → N+2
0,135←0,045 (mol)
Theo định luật bảo toàn e ta có: 3x + 2y = 0,135 (2)
Từ (1) và (2) ta có hệ phương trình:
\(\begin{array}{l}\left\{ \begin{array}{l}56x + 64y = 3,32\\3x + 2y = 0,135\end{array} \right. \to \left\{ \begin{array}{l}x = 0,025\\y = 0,03\end{array} \right.\\ \to \left\{ \begin{array}{l}{m_{Fe}} = 0,025.56 = 1,4(g)\\{m_{Cu}} = 3,32 - 1,4 = 1,92(g)\end{array} \right. \\\to \left\{ \begin{array}{l}\% {m_{Fe}} = \frac{{1,4}}{{3,32}}.100\% = 42,17\% \\\% {m_{Cu}} = 100\% - 42,17\% = 57,83\% \end{array} \right.\end{array}\)
b) BT “N”: nHNO3 sau pư = nHNO3 bđ – 3nFe(NO3)3 – 2nCu(NO3)2 – nNO
= 0,2 – 3.0,025 – 2.0,03 – 0,045 = 0,02 mol
=> CM HNO3 sau pư = n/V = 0,02/0,4 = 0,05 M

