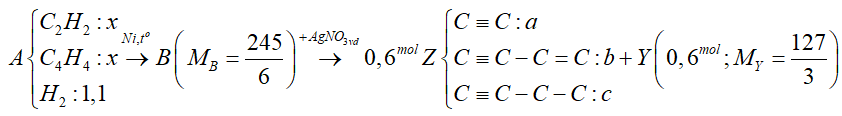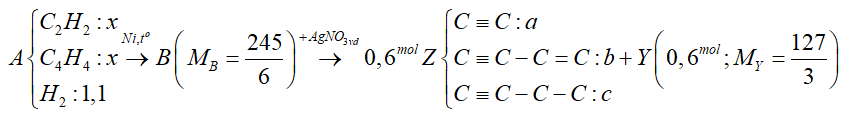Đề bài
I. TRẮC NGHIỆM (4 điểm)
Câu 1 : Chất có khả năng trùng hợp tạo thành cao su là
A. CH2=CHCl.
B. CH2=CH-CH=CH2.
C. CH2=CH2.
D. CF2=CF2.
Câu 2 : Nhóm nguyên tử CH3- có tên là
A. butyl.
B. metyl.
C. etyl.
D. propyl.
Câu 3 : Khi có mặt chất xúc tác Ni ở nhiệt độ thích hợp, anken cộng hiđro vào liên kết đôi tạo thành hợp chất nào dưới đây?
A. anken lớn hơn.
B. ankan.
C. xicloankan.
D. ankin.
Câu 4 : Điều kiện để xảy ra phản ứng cộng H2 vào anken là
A. H+, to.
B. HgCl2, 150-200oC.
C. Ni, to.
D. Pd/PbCO3, to.
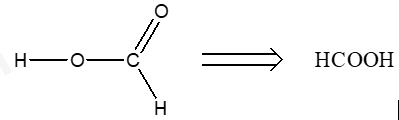
Câu 5 : Hợp chất nào sau đây không phải là anđehit?
A. C6H5-CHO.
B. HCHO.
C. CH3-CHO.
D. HO-CHO.
Câu 6 : Phân tử isopren có số nguyên tử H là
A. 8.
B. 4.
C. 6.
D. 10.
Câu 7 : Toluen có công thức là
A. C6H5-CH=CH2.
B. C6H5-CH3.
C. C6H6.
D. CH2=CH-CH=CH2.
Câu 8 : Chất nào sau đây có khả năng phản ứng với AgNO3/NH3?
A. But-1,3-đien.
B. But-1-in.
C. But-2-in.
D. Pent-2-in.
Câu 9 : Nung một lượng butan trong bình kín (có xúc tác thích hợp) thu được hỗn hợp X gồm ankan và anken. Tỉ khối X so với khí hiđro là 21,75. Thành phần phần trăm thể tích của butan trong X là
A. 25,00%.
B. 33,33%.
C. 66,67%.
D. 50,00%.
Câu 10 : Hiđrocacbon mà trong phân tử có hai liên kết đôi C=C được gọi là
A. ankan.
B. anken.
C. xicloankan.
D. ankađien.
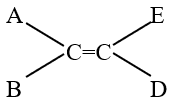
Câu 11 : Chất nào sau đây có đồng phân hình học?
A. CH2=CHCl-CH3.
B. CH3-C≡C-CH3.
C. CH3-CH=CH-CH3.
D. CH2Cl-CH2Cl.
Câu 12 : Khi đốt cháy hoàn toàn ankan thì
A. nH2O = nCO2.
B. nH2O < nCO2.
C. nH2O > nCO2.
D. nH2O = 2nCO2.
Câu 13 : Axetilen (C2H2) thuộc dãy đồng đẳng nào sau đây?
A. Anken.
B. Aren.
C. Ankan.
D. Ankin.
Câu 14 : Công thức phân tử chung của ankan là
A. CnH2n-2 (n ≥ 2).
B. CnH2n+2 (n ≥ 1).
C. CnH2n-6 (n ≥ 6).
D. CnH2n (n ≥ 2).
Câu 15 : Tên thay thế của CH3-CH=O là:
A. etanal.
B. etanol.
C. metanal.
D. metanol.
| Câu 16 : Cho hình vẽ mô tả quá trình định tính các nguyên tố C và H trong hợp chất hữu cơ. Hãy cho biết vai trò của CuSO4 (khan) và biến đổi của nó trong thí nghiệm. A. Định tính nguyên tố H và màu CuSO4 từ màu xanh sang màu trắng. B. Định tính nguyên tố C và màu CuSO4 từ màu trắng sang màu xanh. C. Định tính nguyên tố H và màu CuSO4 từ màu trắng sang màu xanh. D. Định tính nguyên tố C và màu CuSO4 từ màu xanh sang màu trắng. |
II. TỰ LUẬN (6,0 điểm)
Câu 17 : Thực hiện yêu cầu của các câu sau:
1. Đọc tên thường và tên thay thế các chất sau:
a) CH3-CH2-CH2-COOH;
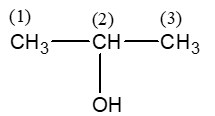
b) CH3-CH(CH3)-OH.
2. Viết công thức cấu tạo có thể có của các chất có công thức phân tử C4H6.
Câu 18 : Nêu hiện tượng và viết phương trình hóa học của phản ứng (nếu có).
1. Sục axetilen vào dung dịch AgNO3/NH3.
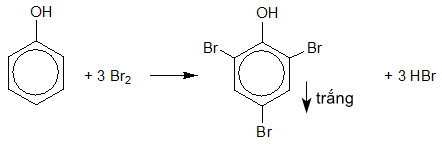
2. Nhỏ nước brom vào phenol lỏng.
3. Cho mẩu Na vào giấm ăn.
Câu 19 : Đốt cháy hoàn toàn hỗn hợp X gồm 2 ancol no, đơn chức, mạch hở là đồng đẳng kế tiếp thu được 5,6 lít khí CO2 (đktc) và 6,3 gam H2O.
1. Tìm công thức phân tử của 2 ancol.
2. Tính % về khối lượng mỗi ancol trong hỗn hợp X.
Câu 20 : Một bình kín A chứa các chất sau: axetilen, vinylaxetilen, hiđro (1,1 mol) và một ít bột niken (trong đó tỉ lệ số mol axetilen và vinylaxetilen là 1:1). Nung nóng bình một thời gian, thu được hỗn hợp khí B có tỉ khối so với H2 bằng 245/12. Khi B phản ứng vừa đủ với AgNO3 (trong dung dịch NH3) thu được 0,6 mol hỗn hợp kết tủa X và 13,44 lít hỗn hợp khí Y (đktc). Biết hỗn hợp Y có tỉ khối so với heli bằng 127/12 và hỗn hợp Y phản ứng tối đa với 0,5 mol Br2 trong dung dịch. Tính khối lượng kết tủa X.
----- HẾT -----
Lời giải chi tiết
ĐÁP ÁN VÀ LỜI GIẢI CHI TIẾT
| 1.B | 2.B | 3.B | 4.C | 5.D | 6.A | 7.B | 8.B |
| 9.D | 10.D | 11.C | 12.C | 13.D | 14.B | 15.A | 16.C |
Câu 1
Phương pháp:
Lý thuyết về ankađien.
Cách giải:
nCH2=CHCl \(\xrightarrow{{{t}^{o}},xt,p}\) (-CH2-CHCl-)n
Poli(vinyl clorua) (PVC)
nCH2=CH-CH=CH2 \(\xrightarrow{{{t}^{o}},xt,p}\) (-CH2-CH=CH-CH2-)n
Cao su buna
nCH2=CH2 \(\xrightarrow{{{t}^{o}},xt,p}\) (-CH2-CH2-)n
Polietilen (PE)
nCF2=CF2 \(\xrightarrow{{{t}^{o}},xt,p}\) (-CF2-CF2-)n
Teflon
Chọn B.
Câu 2
Phương pháp:
Dựa vào danh pháp gốc ankyl.
Cách giải:
Metyl: CH3-
Etyl: CH3CH2-
Propyl: CH3CH2CH2-
Butyl: CH3CH2CH2CH2-
Chọn B.
Câu 3
Phương pháp:
Dựa vào lý thuyết về phản ứng cộng của anken.
Cách giải:
Anken cộng hiđro vào liên kết đôi tạo thành ankan.
CnH2n + H2 \(\xrightarrow{Ni,{{t}^{o}}}\) CnH2n+2.
Chọn B.
Câu 4
Phương pháp:
Dựa vào lý thuyết về phản ứng cộng của anken.
Cách giải:
Điều kiện để xảy ra phản ứng cộng H2 vào anken là Ni, to.
Chọn C.
Câu 5
Phương pháp:
Dựa vào khái niệm hợp chất anđehit.
Cách giải:
Các hợp chất C6H5-CHO, HCHO, CH3-CHO là anđehit.
Hợp chất HO-CHO viết dưới dạng khai triển:
Đây là axit cacboxylic.
Chọn D.
Câu 6
Phương pháp:
Dựa vào công thức phân tử isopren ⟹ số nguyên tử H.
Cách giải:
Isopren: CH2=C(CH3)-CH=CH2 ⟹ CTPT: C5H8 ⟹ có 8 nguyên tử H.
Chọn A.
Câu 7
Phương pháp:
Lý thuyết về hiđrocacbon thơm.
Cách giải:
Toluen có công thức là C6H5-CH3.
Chọn B.
Câu 8
Phương pháp:
Chất hữu cơ có khả năng phản ứng với AgNO3/NH3 phải có nhóm chức CHO, hoặc là ankin có liên kết ba đầu mạch.
Cách giải:
Chất hữu cơ có khả năng phản ứng với AgNO3/NH3 phải có nhóm chức CHO, hoặc là ankin có liên kết ba đầu mạch ⟹ But-1-in phản ứng được với AgNO3/NH3.
PTHH: CH3-CH2-C≡CH + AgNO3 + NH3 → CH3-CH2-C≡CAg + NH4NO3.
Các chất but-1,3-đien, but-2-in, pent-2-in không tác dụng với AgNO3/NH3.
Chọn B.
Câu 9
Phương pháp:
Giả sử xét 1 mol C4H10.
Dùng BTKL ⟹ nX.
⟹ nC4H10 pư = nX - nC4H10 bđ ⟹ nC4H10 dư = nC4H10 bđ - nC4H10 pư ⟹ %VC4H10 trong X.
Cách giải:
Giả sử xét 1 mol C4H10.
dX/H2 = 21,75 ⟹ MX = 43,5
Dùng BTKL: mC4H10 = mX ⟹ 1.58 = 43,5.nX ⟹ nX = 4/3 mol
Ta có: nC4H10 pư = nX - nC4H10 bđ = 4/3 - 1 = 1/3 mol
⟹ nC4H10 dư = nC4H10 bđ - nC4H10 pư = 1 - 1/3 = 2/3 mol
%VC4H10 = \(\frac{{2/3}}{{4/3}}.100\% \) = 50%.
Chọn D.
Câu 10
Phương pháp:
Dựa vào khái niệm về loại hiđrocacbon.
Cách giải:
Hiđrocacbon mà trong phân tử có hai liên kết đôi C=C được gọi là ankađien.
Chọn D.
Câu 11
Phương pháp:
Điều kiện một chất có đồng phân hình học:
- Hợp chất phải có chứa liên kết đôi
- Nhóm A ≠ B; E ≠ D.
Cách giải:
Chất CH3-CH=CH-CH3 thỏa mãn điều kiện có đồng phân hình học.
Chọn C.
Câu 12
Phương pháp:
Dựa vào tính chất hóa học của ankan.
Cách giải:
Công thức phân tử ankan là CnH2n+2.
CnH2n+2 \(\xrightarrow{+{{O}_{2}},{{t}^{o}}}\) n CO2 + (n+1) H2O.
⟹ nCO2 < nH2O.
Chọn C.
Câu 13
Cách giải:
Số πC2H2 = (2.2 + 2 - 2)/2 = 2 ⟹ C2H2 chỉ có thể chứa 1 liên kết ba
⟹ C2H2 thuộc dãy đồng đẳng ankin.
Chọn D.
Câu 14
Phương pháp:
Lý thuyết về ankan.
Cách giải:
Công thức phân tử chung của ankan là: CnH2n+2 (n ≥ 1).
Chọn B.
Câu 15
Phương pháp:
Cách đọc tên thay thế anđehit:
Bước 1: Xác định mạch chính dài nhất (có chứa nhóm CHO và có nhiều nhánh nhất).
Bước 2: Đánh số thứ tự từ đầu CHO.
Bước 3: Sắp xếp và gọi tên nhánh theo thứ tự bảng chữ cái (đối với nhóm chức có nhiều nhóm thì thêm tiền tố chỉ số lượng phía trước: 2 - đi, 3 - tri, 4 - tetra, ….)
Bước 4: Tên thay thế anđehit = Số chỉ vị trí nhánh + tên nhánh + tên hiđrocacbon no tương ứng + al.
Cách giải:
Tên thay thế của CH3-CH=O là: etanal.
Chọn A.
Câu 16
Phương pháp:
Dựa vào tính chất vật lí của CuSO4.
Cách giải:
CuSO4 khan có màu trắng còn CuSO4 ẩm có màu xanh.
⟹ Vai trò của CuSO4 khan trong thí nghiệm trên: Định tính nguyên tố H và màu CuSO4 từ màu trắng sang màu xanh.
Chọn C.
Câu 17
1.
Phương pháp:
1. Cách đọc tên thay thế của axit cacboxylic no, đơn chức, mạch hở:
Tên thay thế = Axit + tên hiđrocacbon no tương ứng với mạch chính + oic
Chú ý: Mạch chính là mạch C dài nhất có chứa nhóm COOH, được đánh số từ nhóm COOH.
2. Danh pháp của ancol:
*Tên thông thường: Ancol + tên gốc hiđrocacbon + ic
*Tên thay thế: Tên hiđrocacbon tương ứng theo mạch chính + số chỉ vị trí nhóm OH + ol
+ Mạch chính được quy định là mạch C dài nhất có chứa nhóm OH
+ Số chỉ vị trí được bắt đầu từ phía gần nhóm OH hơn
Cách giải:
a)
- Tên thường: axit butyric
- Tên thay thế: axit butanoic
b)
- Tên thường: ancol isopropylic
- Tên thay thế: propan-2-ol
2.
Phương pháp:
Xác định số π của hợp chất: \(\pi \text{ }\!\!~\!\!\text{ }=\frac{2C+2-H}{2}\)
⟹ CTCT của hợp chất C4H6.
Cách giải:
Số πC4H6 = (2.4 + 2 - 6)/2 = 2
Trường hợp 1: C4H6 có chứa 1 liên kết ba (ankin)
(1) CH≡C-CH2-CH3
(2) CH3-C≡C-CH3
Trường hợp 2: C4H6 có chứa 2 liên kết đôi (ankađien)
(3) CH2=CH-CH=CH2
(4) CH2=C=CH-CH3
Câu 18
1.
Phương pháp:
Dựa vào tính chất hóa học của axetilen.
Cách giải:
Hiện tượng: Xuất hiện kết tủa màu vàng.
PTHH: CH≡CH + 2AgNO3 + 2NH3 → CAg≡CAg ↓ + 2NH4NO3
2.
Phương pháp:
Dựa vào tính chất hóa học của phenol.
Cách giải:
Hiện tượng: Xuất hiện kết tủa trắng.
PTHH:
3.
Phương pháp:
Dựa vào tính chất hóa học của axit cacboxylic.
Cách giải:
Hiện tượng: Sủi bọt khí không màu.
PTHH: 2CH3COOH + 2Na → 2CH3COONa + H2 ↑
Câu 19
1.
Phương pháp:
Khi đốt cháy ancol no, mạch hở ta luôn có: nancol = nH2O - nCO2.
Tính số nguyên tử C trung bình: Ctb = nCO2/nancol.
Suy ra CTPT của 2 ancol đồng đẳng kế tiếp.
Cách giải:
Ta có: nH2O = 0,35 mol và nCO2 = 0,25 mol
Khi đốt cháy ancol no, mạch hở ta luôn có: nancol = nH2O - nCO2 = 0,35 - 0,25 = 0,1 mol.
⟹ Số Ctb = nCO2/nancol = 0,25/0,1 = 2,5
⟹ CTPT của 2 ancol đồng đẳng kế tiếp là C2H6O và C3H8O.
2.
Phương pháp:
- Đặt ẩn là số mol mỗi ancol.
- Lập hệ phương trình về tổng số mol hỗn hợp và số mol CO2. Giải hệ tìm được số mol mỗi ancol.
- Tính phần trăm khối lượng của mỗi ancol dựa vào công thức:
\(\% {m_X} = \frac{{{m_X}}}{{{m_{hh}}}}.100\% \)
Cách giải:
Gọi nC2H6O = x và nC3H8O = y (mol).
+) nancol = x + y = 0,1 (1)
+) nCO2 = 2x + 3y = 0,25 (2)
Giải hệ trên ta được: x = y = 0,05.
⟹ nC2H5OH = 0,05 và nC3H7OH = 0,05.
⟹ \(\% {m_{{C_2}{H_6}O}} = \frac{{0,05.46}}{{0,05.46 + 0,05.60}}.100\% {\rm{\;}} = 43,4\% \)
⟹ \(\% {m_{{C_3}{H_8}O}} = 100\% {\rm{\;}} - 43,4\% {\rm{\;}} = 56,6\% \)
Câu 20
Phương pháp:
Gọi Z là hỗn hợp khí bị AgNO3 hấp thụ.
Sơ đồ:
*Kết hợp các phương pháp: bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn số mol π, … để xác định x; a; b; c.
Lưu ý:
+ Trong phản ứng cộng của hiđrocacbon: ngiảm = nH2 pư
+ Bảo toàn số mol liên kết π: n π (A) = nH2 pư + n π (Z) + nBr2
*Phản ứng của Z với AgNO3/NH3:
C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH≡C-CH=CH2 + AgNO3 + NH3→ CAg≡C-CH=CH2 ↓ + NH4NO3
CH≡C-CH2-CH3 + AgNO3 + NH3 → CAg≡C-CH2-CH3 ↓ + NH4NO3
Cách giải:
Gọi Z là hỗn hợp khí bị AgNO3 hấp thụ.
Sơ đồ:
Đặt nC2H2 = nC4H4 = x mol
Ta thấy: nB = nZ + nY = 0,6 + 0,6 = 1,2 mol
Ta có: mB = nB.MB = 1,2.2.245/12 = 49 gam = mA (theo BTKL)
⟹ mA = 26x + 52x + 1,1.2 = 49 ⟹ x = 0,6 mol
Trong phản ứng cộng của hiđrocacbon thì số mol giảm là số mol H2 phản ứng
⟹ nH2 pư = nA - nB = (0,6 + 0,6 + 1,1) - 1,2 = 1,1 mol
+) Bảo toàn số mol liên kết π: n π (A) = nH2 pư + n π (Z) + nBr2
⟹ 2nC2H2 bđ + 3nC4H4 bđ = nH2 pư + (2nC2H2(Z) + 3nC4H4(Z) + 2nC4H6(Z)) + nBr2
⟹ 2.0,6 + 3.0,6 = 1,1 + 2a + 3b + 2c + 0,5 (1)
+) nhh Z = a + b + c = 0,6 (2)
+) BTKL cho toàn bộ quá trình: mA = mZ + mY
⟹ 49 = 26a + 52b + 54c + 0,6.(127/3) (3)
Giải hệ (1) (2) (3) được a = 0,3; b = 0,2; c = 0,1.
*Xét phản ứng của Z với AgNO3/NH3:
C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
0,3 → 0,3 (mol)
CH≡C-CH=CH2 + AgNO3 + NH3→ CAg≡C-CH=CH2 ↓ + NH4NO3
0,2 → 0,2 (mol)
CH≡C-CH2-CH3 + AgNO3 + NH3 → CAg≡C-CH2-CH3 ↓ + NH4NO3
0,1 → 0,1 (mol)
⟹ mkết tủa = 0,3.240 + 0,2.159 + 0,1.161 = 119,9 gam.