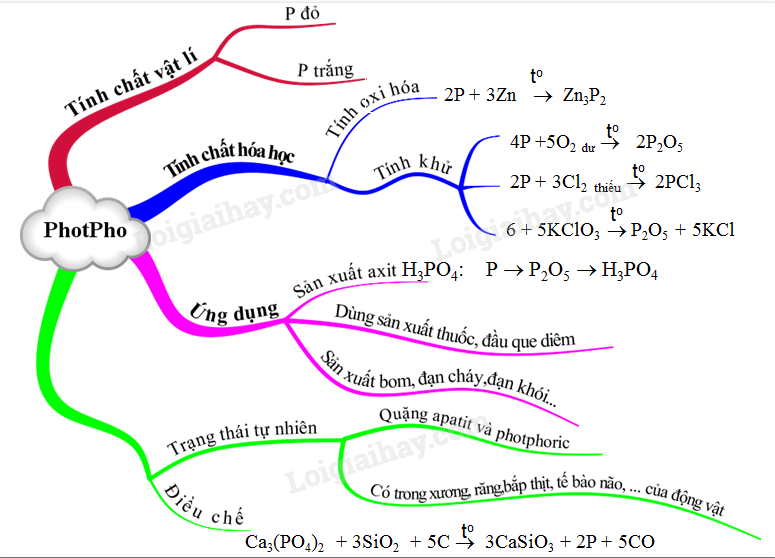
I. VỊ TRÍ VÀ CẤU HÌNH
- Trong bảng tuần hoàn photpho ở ô thứ 15, nhóm VA, chu kì 3.
- Cấu hình electron lớp ngoài cùng: 1s22s22p63s23p3.
II. TÍNH CHẤT VẬT LÍ
1. Photpho trắng
Chất rắn màu trắng hoặc hơi vàng, rất độc, dễ gây bỏng nặng khi rơi vào da; mềm và dễ nóng chảy; không tan trong nước và dễ tan trong dung môi hữu cơ.
2. Photpho đỏ
- Chất rắn có màu đỏ, không độc, dễ hút ẩm và chảy rữa; không tan trong các dung môi thông thường.
P đỏ (rắn) \(\overset{t^{0}cao}{\rightarrow}\) P đỏ (hơi) → P trắng.
- Hai dạng này khác nhau về tính chất vật lí do chúng khác nhau về cấu trúc tinh thể và khả năng liên kết. Trong hai dạng thù hình photpho trắng hoạt động hơn photpho đỏ.
III. TÍNH CHẤT HÓA HỌC
- Độ âm điện P < N.
- Nhưng P hoạt động hóa học hơn N2 vì liên kết N ≡ N bền vững.
- P trắng hoạt động hơn P đỏ.
1. Tính OXH
- Tác dụng với kim loại hoạt động mạnh:
\(2\overset{0}{\mathop{P}}\,+3Ca\xrightarrow{{{t}^{o}}}\underset{canxi\ photphua}{\mathop{C{{a}_{3}}\overset{-3}{\mathop{{{P}_{2}}}}\,}}\,\)
2. Tính khử:
- Tác dụng với oxi, halogen, lưu huỳnh...
\(4\mathop {P\,\,\,\,}\limits^0 + \,\,\,\,5{O_2} \to \mathop {2\mathop {{P_2}{O_5}}\limits^{ + 5} }\limits_{diphotpho{\kern 1pt} pentaoxit} \)
2P + 5Cl2 \(\xrightarrow{{{t^o}}}\) 2PCl5
- Tác dụng với hợp chất:
P + 5HNO3 → H3PO4 + 5NO2 + H2O
IV. TRẠNG THÁI TỰ NHIÊN
Trong tự nhiên photpho nằm ở dạng muối của axit photphoric. Hai khoáng vật chính của photpho là aptit 3Ca3(PO4)2 . CaF2 và photphorit Ca3(PO4)2.
V. ĐIỀU CHẾ
- Trong công nghiệp, photpho được sản xuất bằng cách nung hỗn hợp quặng photphorit, cát và than cốc ở 12000C trong lò điện:
Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 2P + 5CO
- Phần lớn photpho sản xuất ra được dùng để sản xuất axit photphoric, phần còn lại chủ yếu dùng trong sản xuất diêm. Ngoài ra, photpho còn được dùng vào mục đích quân sự: sản xuất bom, đạn cháy, đạn khói,…
Sơ đồ tư duy: Photpho