Đề bài
Hiđrocacbon X là chất lỏng có tỉ khối hơi so với không khí bằng 3,17. Đốt cháy hoàn toàn X thu được CO2 có khối lượng bằng 4,28 lần khối lượng H2O. Ở nhiệt độ thường, X không làm mất màu dung dịch brom. Khi đun nóng, X làm mất màu dung dịch KMnO4.
a) Tìm công thức phân tử và viết công thức cấu tạo của X.
b) Viết phương trình hóa học của phản ứng giữa X và H2 (xúc tác Ni, đun nóng), với brom (có mặt Fe), với hỗn hợp dư của axit HNO3 và axit H2SO4 đậm đặc.
Video hướng dẫn giải
Phương pháp giải - Xem chi tiết
a)
Gọi CTPT của X là CxHy
MX = 3,17.29 = 92
=> 12x + y = 92 (1)
\(\begin{gathered}
{C_x}{H_y} + (x + \,\frac{y}{4}){O_2}\xrightarrow{{{t^0}}}xC{O_2}\,\,\,\, + \,\,\,\,\,\frac{y}{2}{H_2}O \hfill \\
1\,(mol)\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\xrightarrow{{}}x(mol)\xrightarrow{{}}0,5y(mol) \hfill \\
\frac{{{m_{C{O_2}}}}}{{{m_{{H_2}O}}}} = \frac{{44x}}{{0,5y.18}} = 4,28 \hfill \\
= > y = 1,14x\,\,\,(2) \hfill \\
\end{gathered} \)
Từ (1) và (2) => x = ? và y = ?
=> CTPT của X là ? => CTCT X =?
b)
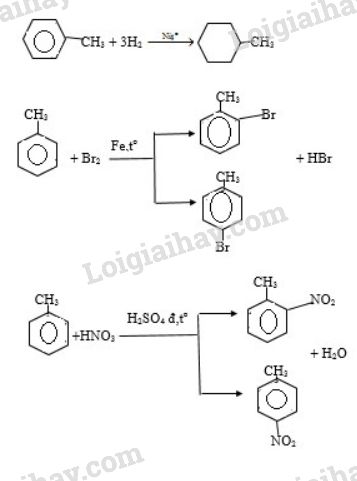
X + H2 (Ni, t0) → phản ứng cộng phá vỡ liên kết I trong vòng benzen
X + Br2 ( bột Fe)→ phản ứng thế vào vòng benzen vị trí o, p
X + HNO3 đặc ( xt H2SO4 đặc) → phản ứng thế vào vòng benzen vị trí o, p
Lời giải chi tiết
Gọi CTPT của X là CxHy
MX = 3,17.29 = 92
=> 12x + y = 92 (1)
\(\begin{gathered}
{C_x}{H_y} + (x + \,\frac{y}{4}){O_2}\xrightarrow{{{t^0}}}xC{O_2}\,\,\,\, + \,\,\,\,\,\frac{y}{2}{H_2}O \hfill \\
1\,(mol)\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\xrightarrow{{}}x(mol)\xrightarrow{{}}0,5y(mol) \hfill \\
\frac{{{m_{C{O_2}}}}}{{{m_{{H_2}O}}}} = \frac{{44x}}{{0,5y.18}} = 4,28 \hfill \\
= > y = 1,14x\,\,\,(2) \hfill \\
\end{gathered} \)
Từ (1) và (2) => x = 7 và y = 8
=> CTPT của X là C7H8
X là chất lỏng, không làm mất màu dd nước brom, làm mất màu dd KMnO4 khi đun nóng => X là C6H5CH3
b)