I. ĐỒNG ĐẰNG, ĐỒNG PHÂN, DANH PHÁP
1. Đồng đẳng
- Công thức tổng quát chung cho ankan là CnH2n+2 (n ≥ 1).
- Tên gọi chung là ankan hay paraffin.
- Công thức đơn giản nhất là metan (CH4).
- Mạch cacbon hở, có thể phân nhánh hoặc không phân nhánh.
- Trong phân tử chỉ có liên kết đơn (liên kết, …) tạo thành từ 4 obitan lai hóa sp3 của nguyên tử cacbon, định hướng kiểu tứ diện đều. Do đó mạch cacbon có dạng gấp khúc. Các nguyên tử cacbon có thể quay tương đối tự do xung quanh các liên kết đơn.
2. Đồng phân
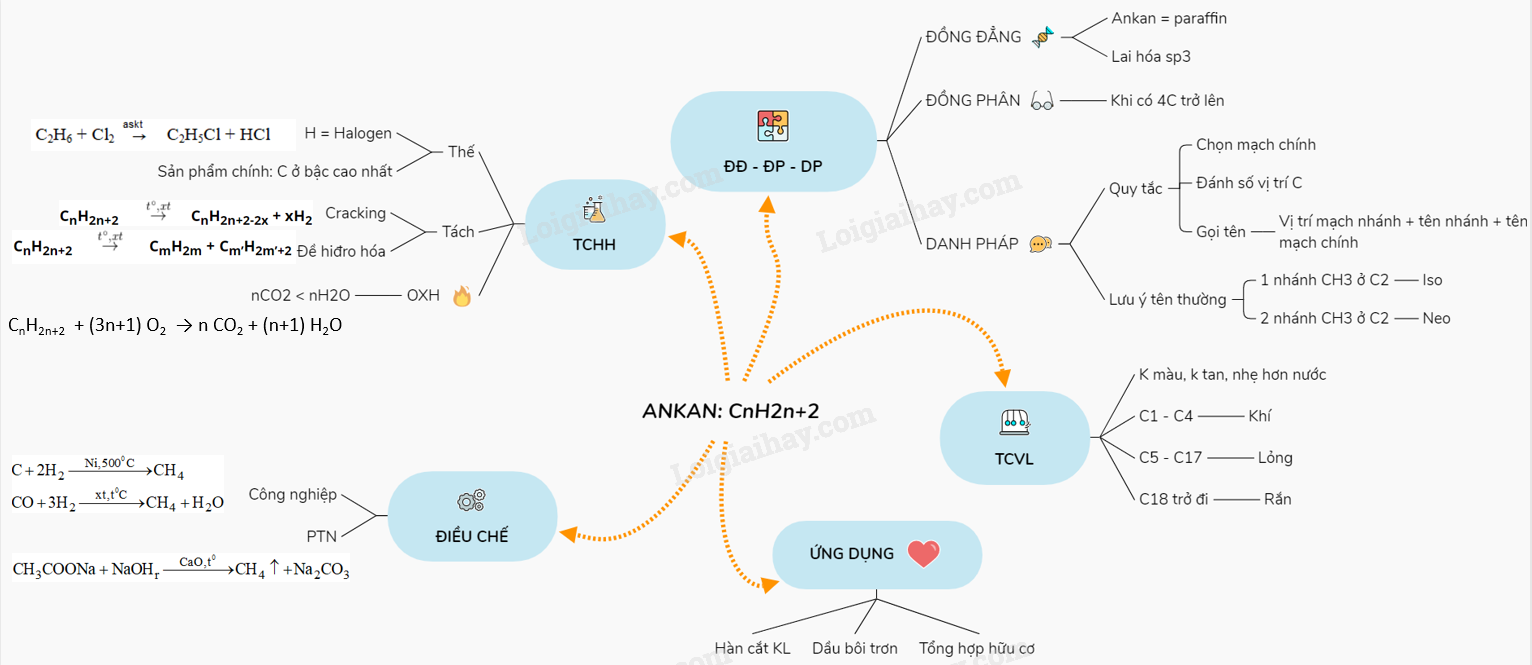
Ankan chỉ có đồng phân mạch C khi có từ 4C trở lên.
Ví dụ: Các đồng phân của C5H12.
3. Danh pháp
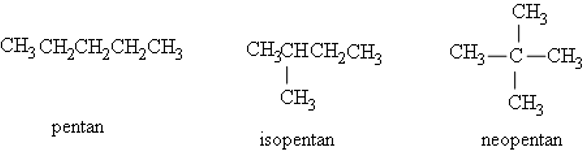
– Phân tử có mạch nhánh thì gọi theo quy tắc sau:
+ Chọn mạch chính: là mạch dài nhất có nhiều nhóm thế nhất.
+ Đánh số vị trí cacbon trong mạch chính bắt đầu từ phía gần nhánh hơn.
+ Gọi tên: Vị trí mạch nhánh + tên nhánh + tên mạch chính (tên ankan tương ứng với số nguyên tử cacbon trong mạch chính).
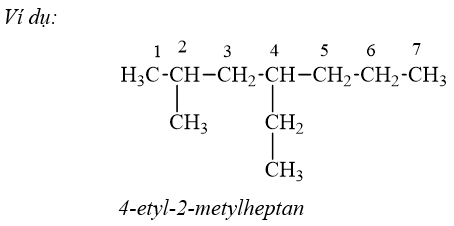
*Lưu ý:
- Tên thường:
+ Nếu chỉ có một nhánh duy nhất CH3 ở nguyên tử C số 2 thì thêm tiền tố iso.
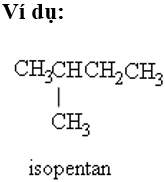
+ Nếu có 2 nhánh CH3 ở C số 2 thì thêm tiền tố neo.
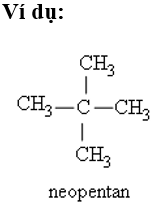
- Gốc hiđrocacbon là phần còn lại của phân tử hidrocacbon sau khi bớt đi một số nguyên tử hiđro nhưng vẫn còn tồn tại trong phân tử ở trạng thái liên kết và không mang electron tự do như gốc tự do.
- CTTQ nhóm ankyl: CnH2n+1
- Bậc của một nguyên tử cacbon trong phân tử ankan bằng số nguyên tử cacbon liên kết trực tiếp với nó.
II. TÍNH CHẤT VẬT LÍ
- Ở điều kiện thường ankan từ C1 → C4 ở trạng thái khí, từ C5 → C17 trở đi ở trạng thái lỏng, từ C18 trở lên ở dạng rắn. Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của ankan nói chung tăng theo chiều tăng của phân tử khối.
- Ankan là những chất không màu, không tan trong nước, nhẹ hơn nước nhưng tan nhiều trong dung môi hữu cơ.
III. TÍNH CHẤT HÓA HỌC
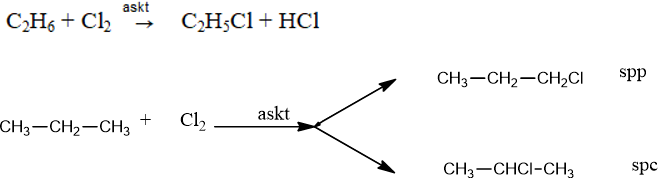
1. Phản ứng thế
- Nguyên tử H bị thế bằng halogen tạo dẫn xuất halogen:
CnH2n+2 + x Cl2 → CnH2n+2-xClx + x HCl (x ≤ 2n+2)
- Đối với ankan phân tử có các nguyên tử C có bậc khác nhau, sản phẩm chính thế H ở C bậc cao hơn.
2. Phản ứng tách
- Tách hiđro (đề hiđro hóa): CnH2n+2 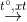 CnH2n+2-2x + xH2
CnH2n+2-2x + xH2
- Bẻ gãy các liên kết C-C ( cracking): CnH2n+2 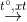 CmH2m + Cm’H2m’+2 (n = m + m’)
CmH2m + Cm’H2m’+2 (n = m + m’)
3. Phản ứng oxi hóa( đốt cháy)
Ankan cháy tạo ra nhiều nhiệt:
CnH2n+2 + \(\dfrac{{3n + 1}}{2}\) O2 → n CO2 + (n+1) H2O
Nhận xét:
+ Đốt ankan thu nCO2 < nH2O
+ Nếu đốt hiđrocacbon thu được nCO2 < nH2O ⇒ Hiđrocacbon đem đốt là ankan (CnH2n+2).
IV. ĐIỀU CHẾ
- Trong công nghiệp, metan và các đồng đẳng được lấy từ khí thiên nhiên, khí mỏ dầu và dầu mỏ.
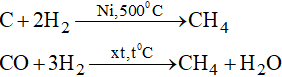
- Trong phòng thí nghiệm, ankan được điều chế bằng cách nung muối natri của axit cacboxylic với vôi tôi xút.
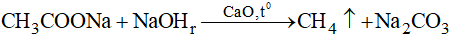
V. ỨNG DỤNG
- Dùng làm nhiên liệu trong hàn cắt kim loại.
- Dùng làm dầu bôi trơn, dung môi.
- Để tổng hợp nhiều chất hữu cơ khác: CH3Cl, CH2Cl2, CCl4, CF2Cl2, ...
- Đặc biệt từ CH4 điều chế được nhiều chất khác nhau: hỗn hợp CO + H2, ammoniac, C2H2, rượu metylic, andehit fomic, …
Sơ đồ tư duy: Ankan