Đề bài
I. PHẦN TRẮC NGHIỆM
Câu 1. Dãy chất nào sau đây chỉ chứa các hợp chất hữu cơ?
\(\begin{array}{l}A.{\left( {N{H_4}} \right)_2}C{O_3},C{O_2},C{H_4},{C_2}{H_6}\\B.{C_2}{H_4},C{H_4},{C_2}{H_6}O,{C_3}{H_9}N\\C.C{O_2},{K_2}C{O_3},NaHC{O_3},{C_2}{H_5}Cl\\D.N{H_4}HC{O_3},C{H_3}OH,C{H_4},CC{l_4}\end{array}\)
Câu 2. Khi phân tích một hợp chất hữu cơ (X) có thành phần như sau: %C = 52,17%;%H = 13,04% và %O = 34,78%. Công thức phân tử của (X) là (biết công thức nguyên trùng công thức phân tử):
A. C2H6O B. C3H8O
C. CH4O D. C4H10O
Câu 3. Khi đốt cháy hoàn toàn một hiđrocacbon (X) thu được số mol CO2 bằng \(\dfrac{1}{2}\) số mol H2O. Công thức phân tử của hiđrocacbon (X) là:
A. C2H6 B. C2H4
C. C6H6 D. CH4
Câu 4: Đặc điểm chung của các phân tử hợp chất hữu cơ là
1. thành phần nguyên tố chủ yếu là C và H.
2. có thể chứa nguyên tố khác như Cl, N, P, O.
3. liên kết hóa học chủ yếu là liên kết cộng hoá trị.
4. liên kết hoá học chủ yếu là liên kết ion.
5. dễ bay hơi, khó cháy.
A. 4, 5, 6.
B. 1, 2, 3.
C. 1, 3, 5.
D. 2, 4, 6.
Câu 5. Đốt cháy một hỗn hợp hiđtocacbon, thu được 2,24 lít CO2 (đktc) và 2,7 gam H2O. Thể tích O2 (đktc) tham gia phản ứng là:
A. 3,92 lít B. 3,36 lít
C. 5,60 lít D. 4,48 lít
Câu 6. Thể tích hóa hơi 1 gam chất (X) bằng một nửa thể tích của 1 gam không khí (đo ở cùng điều kiện). Phân tử khối của chất (X) là:
A.29 B.58
C.44 D.46
Câu 7: Các chất trong nhóm chất nào dưới đây đều là dẫn xuất của hiđrocacbon ?
A. CH2Cl2, CH2Br-CH2Br, NaCl, CH3Br, CH3CH2Br
B. CH2Cl2, CH2Br-CH2Br, CH3Br, CH2=CHCOOH, CH3CH2OH
C. CH2Br-CH2Br, CH2=CHBr, CH3Br, CH3CH3
D. HgCl2, CH2Br-CH2Br, CH2=CHBr, CH3CH2Br
Câu 8: Nhận xét nào đúng về các chất hữu cơ so với các chất vô cơ ?
A. Độ tan trong nước lớn hơn.
B. Độ bền nhiệt cao hơn.
C. Tốc độ phản ứng nhanh hơn.
D. Nhiệt độ nóng chảy, nhiệt độ sôi thấp hơn.
II. PHẦN TỰ LUẬN
Câu 9. Có bao nhiêu đồng phân (không kể đồng phân hình học) của hợp chất trong công thức phân tử C4H8?
Câu 10. Đốt cháy 0,3gam chất A chứa các nguyên tố C, H, O ta thu được 224cm3 khí cacbonic (đktc) và 1,8 gam nước. Tỉ khối hơi của khí A đối với hiđro bằng 30. Xác định công thức phân tử của A.
Câu 11. Khi phân tích 6,4 gam một hợp chất hữu cơ X thu được 8,8 gam CO2 và 7,2 gam H2O. Hỏi thành phần phần trăm theo khối lượng của oxi trong X là bao nhiêu?
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
| Câu | 1 | 2 | 3 | 4 |
| Đáp án | B | A | D | B |
| Câu | 5 | 6 | 7 | 8 |
| Đáp án | A | B | B | D |
Câu 1:
A loại vì (NH4)2CO3; CO2 là hợp chất vô cơ
C loại vì CO2, K2CO3, NaHCO3 là hợp chất vô cơ
D loại vì NH4HCO3 là hợp chất vô cơ
Đáp án B
Câu 2:
n C : n H : n O = \(\frac{{52,17}}{{12}}:\frac{{13,04}}{1}:\frac{{34,78}}{{16}}\)
= 4,3475: 13,04 : 2,17375
= 2 : 6 : 1
=> X là C2H6O
Đáp án A
Câu 3:
Gọi công thức phân tử của X là CxHy
Ta có phương trình:
CxHy + O2 x CO2 + y/2 H2O (1)
n CO2 = ½ n H2O
(1) => x = ½ . (y/2)
=> x = ¼ y
Chất phù hợp là CH4
Đáp án D
Câu 4:
Đặc điểm chung của các phân tử hợp chất hữu cơ là
1. thành phần nguyên tố chủ yếu là C và H.
2. có thể chứa nguyên tố khác như Cl, N, P, O.
3. liên kết hóa học chủ yếu là liên kết cộng hoá trị.
Đáp án B
Câu 5:
n CO2 = V/22,4 = 2,24 : 22,4 = 0,1 mol
n H2O = m/M = 2,7 : 18 = 0,15 mol
Áp dụng định luật bảo toàn nguyên tố O ta có:
n O2 = ½ n O = (0,1 . 2 + 0,15 ) : 2 = 0,175 mol
=> V O2 = 0,175 . 22,4 = 3,92 lít
Đáp án A
Câu 6:
Xét 1 gam chất X và 1 gam không khí có V X = ½ V không khí.
=> M X = 2 M không khí = 2 . 29 = 58 (gam/mol)
Đáp án B
Câu 7:
Nhóm chất đều là dẫn xuất của hiđrocacbon là CH2Cl2, CH2Br–CH2Br, CH3Br, CH2=CHCOOH, CH3CH2OH.
Đáp án B
Câu 8:
Nhận xét đúng là: Nhiệt độ nóng chảy, nhiệt độ sôi thấp hơn.
- Tính chất vật lý của hợp chất hữu cơ
+ Nhiệt độ nóng chảy, nhiệt độ sôi thấp.
+ Phần lớn không tan trong nước, nhưng tan nhiều trong các dung môi hữu cơ.
Đáp án D
II. PHẦN TỰ LUẬN
Câu 9.
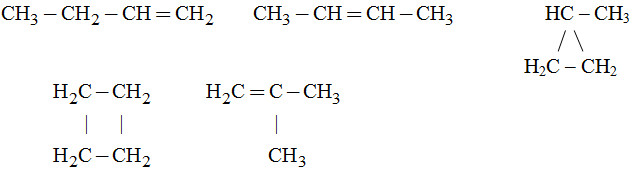
Câu 10.
Ta có: \({d_{A/{H_2}}} = \dfrac{{{M_A}}}{{{M_{{H_2}}}}} = 30\)
\(\Rightarrow {M_A} = 30 \times 2 = 60\left( u \right)\)
Khối lương các nguyên tố:
\(\begin{array}{l}{m_C} = {n_{C{O_2}}} \times 12 = \dfrac{{0,224}}{{22,4}} \times 12 = 0,12\left( {gam} \right)\\{m_H} = {m_{{H_2}O}} \times 2 = \dfrac{{0,18}}{{18}} \times 12 = 0,02\left( {gam} \right)\\{m_O} = {m_A} - \left( {{m_C} + {m_H}} \right)\\ \,\;\;\;\;\;\; = 0,3 - \left( {0,12 + 0,02} \right) = 0,16\left( {gam} \right)\end{array}\)
Lập tỉ lệ:
\(x:y:z = \dfrac{{{m_C}}}{{12}}:\dfrac{{{m_H}}}{1}:\dfrac{{{m_O}}}{{16}} \)\(\,= \dfrac{{0,12}}{{12}}:\dfrac{{0,02}}{1}:\dfrac{{0,16}}{{16}} = 1:2:1\)
\( \Rightarrow \) Công thức nguyên tử A: (CH2O)n
Mà: \({M_A} = 30.n = 60 \Rightarrow n = 2.\)
Vậy công thức phân tử của A: C2H4O2.
Câu 3.
Ta có:
\({m_O} = 6,4 - \left( {\dfrac{{8,8}}{{44}} \times 12 + \dfrac{{7,2}}{{18}} \times 2} \right)\)\(\, = 3,2\left( {gam} \right)\)
\( \Rightarrow \% {m_O} = \dfrac{{3,2}}{{6,4}} \times 100\% = 50\% .\)

