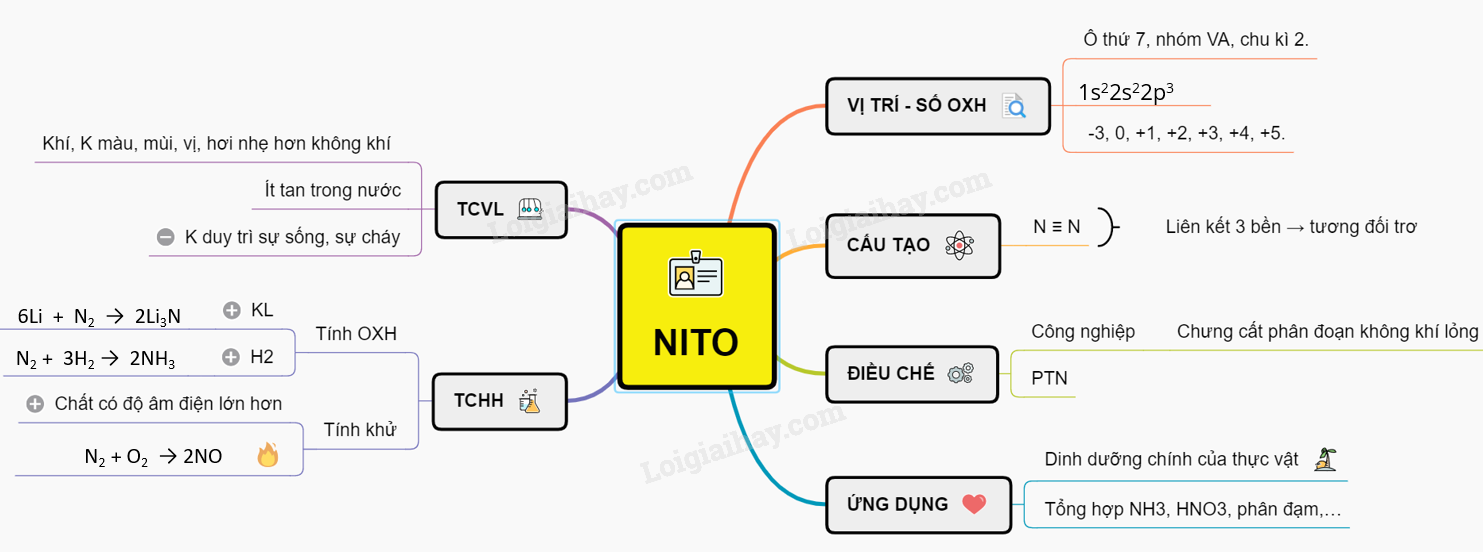
I. VỊ TRÍ VÀ SỐ OXH
- Trong bảng tuần hoàn nitơ nằm ở ô thứ 7, nhóm VA, chu kì 2.
- Cấu hình electron lớp ngoài cùng là 2s22p3.
- N có các số oxi hóa thường gặp: -3, 0, +1, +2, +3, +4, +5.
- N có số oxi hóa cao nhất là +5, nhưng hóa trị cao nhất chỉ là 4.
II. CẤU TẠO PHÂN TỬ
- Nitơ: N ≡ N.
- Liên kết ba giữa hai nguyên tử nitơ bền nên ở điều kiện thường nitơ tương đối trơ và khó tham gia phản ứng hóa học.
III. TÍNH CHẤT VẬT LÍ
Ở điều kiện thường nitơ là khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hóa lỏng ở -1960C; rất ít tan trong nước; không duy trì sự sống, sự cháy
IV. TÍNH CHẤT HÓA HỌC
- Nitơ có các số oxi hoá: -3, 0, +1, +2, +3, +4, +5.
- N2 có số oxi hoá 0 nên vừa thể hiện tính oxi hoá và tính khử
1. Tính oxi hóa
a) Tác dụng với kim loại:
6Li + N2 → 2Li3N
(Nito tác dụng với Liti ở nhiệt độ thường)
- Ở nhiệt độ cao, nitơ tác dụng với nhiều kim loại.
3Mg + N2 → Mg3N2 magie nitrua
b) Tác dụng với hidro:
\({{N}_{2}}\,(k) + 3{{H}_{2}}\,(k) \,\,\underset{{}}{\overset{{{t}^{o}},xt}{\longleftrightarrow}} 2N{{H}_{3}}\,(k)\)
2. Tính khử
Nito thể hiện tính khử khi tác dụng với chất có độ âm điện lớn hơn:
- Ở nhiệt độ cao (3000oC) Nitơ phản ứng với oxi tạo nitơ monoxit.
N2 + O2 ↔ 2NO (không màu)
- Ở điều kiện thường, nitơ monoxit tác dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ.
2NO + O2 → 2NO2
V. ĐIỀU CHẾ
- Trong công nghiệp: Chưng cất phân đoạn không khí lỏng.
- Trong phòng thí nghiệm:
NH4NO2 \(\overset{t^{0}}{\rightarrow}\) N2 + 2H2O
Hoặc: NH4Cl + NaNO2 \(\overset{t^{0}}{\rightarrow}\) N2 + 2H2O + NaCl
VI. ỨNG DỤNG
- Nguyên tố nitơ là thành phần dinh dưỡng chính của thực vật.
- Trong công nghiệp: dùng để tổng hợp NH3, HNO3, phân đạm,…
Chu trình Nitơ trong tự nhiên
Sơ đồ tư duy: Nitơ