A. NHÔM
I. VÍ TRÍ VÀ CẤU TẠO
- Al: 1s22s22p63s23p1
=> Số hiệu nguyên tử 13, thuộc nhóm IIIA, chu kì 3.
- Trong hợp chất, Al có số OXH bền là +3
- Nhôm có cấu tạo mạng tinh thể lập phương tâm diện
II. TÍNH CHẤT VẬT LÍ
- Nhôm là kim loại nhẹ, màu trắng bạc.
- Nhôm rất dẻo, dẫn điện, dẫn nhiệt rất tốt.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với phi kim
- Với oxi: Ở to thường tạo lớp màng oxit bảo vệ. Nếu đốt bột nhôm thì sẽ phản ứng mạnh.
4Al + 3O2 \(\xrightarrow{{{t}^{o}}}\) 2Al2O3
- Với phi kim khác:
+ Với Cl2, Br2 phản ứng ngay ở to thường tạo thành AlCl3, AlBr3 phản ứng bốc cháy.
Ví dụ:
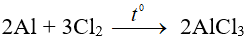
+ Khi đun nóng, phản ứng được với I2, S. Khi đun nóng mạnh, phản ứng được với N2, C.
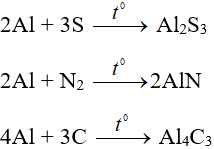
2. Tác dụng với axit
- Al + dung dịch axit (HCl, H2SO4) → muối + H2
2Al + 6H+ → 2Al3+ + 3H2
- Al + dung dịch axit (có tính OXH mạnh) → muối + sản phẩm khử + H2O
4Al + 4HNO3 loãng \(\xrightarrow{{{t}^{o}}}\) Al(NO3)3 + NO + 2H2O
2Al + 6H2SO4 đặc \(\xrightarrow{{{t}^{o}}}\) Al2(SO4)3 + 3SO2 + 6H2O
- Al không tác dụng với H2SO4, HNO3 đặc nguội.
3. Tác dụng với oxit kim loại
Ở nhiệt độ cao, Al khử được nhiều oxit kim loại như Fe2O3, Cr2O3,... thành kim loại tự do.
2Al + Fe2O3 \(\xrightarrow{{{t}^{o}}}\) Al2O3 + 2Fe
4. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 6H2O → 2Na\(\left[ Al{{(OH)}_{4}} \right]\)(dd) + 3H2
IV. ỨNG DỤNG VÀ SẢN XUẤT
1. Ứng dụng
- Người ta dùng nhôm để chế tạo vỏ máy bay, tên lửa, tàu vũ trụ do đặc tính nhẹ, bền với không khí và nước
- Làm dây dẫn điện cao áp, đồ nội thất, làm vật trao đổi nhiệt
- Chế tạo hỗn hợp tecmit (Al và Fe2O3) được dùng để hàn gắn đường ray.
2. Sản xuất
Điện phân nóng chảy Al2O3
2Al2O3 \(\xrightarrow{\text{đpnc}}\) 4Al + 3O2
B. MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA NHÔM
I. NHÔM OXIT
Tính chất vật lí : là chất rắn màu trắng, không tan trong nước nóng chảy ở 2050 độ C
Tính chất hóa học : Al2O3 là oxit lưỡng tính, tác dụng được với dung dịch axit và dung dịch kiềm:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH + 3H2O → 2Na\(\left( Al{{(OH)}_{4}} \right)\)
Ứng dụng :
- Tinh thể Al2O3 (corinđon) được dùng làm đồ trang sức, chế tạo các chi tiết trong các ngành kĩ thuật chính xác, như chân kính đồng hồ, thiết bị phát tia lade,...
- Bột Al2O3 có độ cứng cao được dùng làm vật liệu mài.
- Boxit Al2O3.2H2O là nguyên liệu sản xuất nhôm kim loại.
II. NHÔM HIDROXIT
Tính chất vật lí: Là chất kết tủa keo, màu trắng, không tan trong nước, dễ bị nhiệt phân hủy
Tính chất hóa học :
- Dễ bị nhiệt phân thành nhôm oxit :
2Al(OH)3 \(\xrightarrow{{{t}^{o}}}\) Al2O3 + 3H2O
- Là hợp chất lưỡng tính, tan trong axit và bazo
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → Na\(\left[ Al{{(OH)}_{4}} \right]\)
Điều chế: Cho muối nhôm phản ứng với dung dịch NH3 hoặc muối Na2CO3 :
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaCl + 3CO2↑
III. NHÔM SUNFAT
- Al2(SO4)3: là chất bột màu trắng, bị phân hủy nhiệt trên 770oC
- Phèn chua: K2SO4.Al2(SO4)3.24H2O hoặc : KAl(SO4)2.12H2O tồn tại ở dạng tinh thể có vị hơi chua và chát.
Sơ đồ tư duy: Nhôm và hợp chất của nhôm


