Đề bài
Câu 1. Phương pháp nhận biết các ion kim loại kiềm:
1. Thử màu ngọn lửa.
2. Tạo muối màu đặc trưng cho từng ion.
C. Tạo kết tủa đặc trưng cho từng ion.
Các phương pháp đúng là
A. 1
B. 1, 2.
C. 3.
D. 2, 3.
Câu 2. Để nhận biết ra sự có mặt của ion X trong dung dịch, người ta thêm kiềm vào dung dịch cần phân tích, đặt mẩu giấy quỳ ẩm trên miệng ống nghiệm chứa dung dịch rồi đun nóng nhẹ. X là ion nào trong số các ion sau đây?
\(\begin{array}{l}A.\,SO_3^{2 - }.\\B.\,A{l^{3 + }}.\\C.\,NH_4^ + .\\D.\,NO_3^ - .\end{array}\)
Câu 3. Dung dịch A tạo kết tủa màu trắng với dung dịch \(BaC{l_2}\) và tạo kết tủa màu nâu đen với dung dịch NaOH. Dung dịch A là
\(\begin{array}{l}A.\,FeS{O_4}.\\B.\,AgN{O_3}.\\C.\,N{a_2}C{O_3}.\\D.\,CuS{O_4}.\end{array}\)
Câu 4. Dung dịch Y chứa \(N{a^ + }\) và một anion. Y tác dụng với \(BaC{l_2}\) thu được kêt tủa trắng tan trong axit. Thêm nước brom vào Y rồi mới cho tác dụng với \(BaC{l_2}\) thì được kết tủa không tan trong axit. Y chứa anion nào trong số các anion sau đây?
\(\begin{array}{l}A.\,CO_3^{2 - }\\B.\,HCO_3^ - \\C.\,SO_3^{2 - }\\D.\,SO_4^{2 - }\end{array}\)
Câu 5. Dùng thêm 1 thuốc thử nào dưới đây có thể phân biệt được các dung dịch không nhãn bằng phương pháp hóa học: \(AlC{l_3},\,ZnC{l_2},\,CuC{l_2},\,Fe{(N{O_3})_2},\)\(\,NaCl\) đựng trong các lọ mất nhãn?
A. Dung dịch NaOH.
B. Dung dịch \(N{a_3}P{O_4}\)
C. Dung dịch \(Ba{(OH)_2}\)
D. Dung dịch \(N{H_3}\)
Câu 6. Có 3 dung dịch \(NaOH,\,HCl,\,{H_2}S{O_4}\) loãng. Thuốc thử duy nhất để phân biệt 3 dung dịch là
A. bột Zn.
B. bột \(AgN{O_3}\)
C. bột \(BaC{O_3}\)
D. Quỳ tím.
Câu 7. Nhóm nào sau đây chứa các hóa chất mà mỗi chất đều có thể phân biệt được dung dịch \({H_2}S{O_4}\) loãng và dung dịch \({(N{H_4})_2}S{O_4}\) bão hòa?
A. Quỳ tím; NaOH.
B. Cu, Ba.
C. \(BaC{l_2};Ba{(OH)_2}\)
D. \(NaHC{O_3};KOH\)
Câu 8. Để kết tủa hoàn toàn \(F{e^{2 + }}\) từ dung dịch \(FeS{O_4}\) dưới dạng FeS cần cho cần cho dung dịch \(FeS{O_4}\) tác dụng với
A. \({H_2}S\)
B. \(N{a_2}S\)
C. ZnS.
D. B hoặc C
Câu 9. Kết quả một thí nghiệm cho biết, trong một dung dịch co chứa bốn ion gồm 0,03 mol \(N{a^ + };\,0,02mol\,C{a^{2 + }};\,0,05\,mol\,\)\(HCO_3^ - ;\,0,02\,mol\,C{l^ - }.\) Kết luận nào sau đây đúng?
A. Kết quả đo bị sai.
B. Nước có thể mất độ cứng sau khi đun nóng.
C. Dùng \(Ca{(OH)_2}\) không làm giảm độ cứng của nước
D. Chỉ có thể loại bỏ độ cứng bằng các muối như: \(N{a_2}C{O_3},N{a_3}P{O_4}...\)
Câu 10. Phân biệt trực tiếp dung dịch \(FeS{O_4}\) và dung dịch \(S{O_2}\) cùng nồng độ có thể dùng thuốc thử nào sau đây?
A. Dung dịch \((KMn{O_4} + {H_2}S{O_4})\) loãng.
B. Dung dịch \(Ba{(OH)_2}.\)
C. Giấy quỳ tím.
D. Dung dịch \(N{H_4}Cl.\)
Lời giải chi tiết
Câu 1. Chọn A.
Các ion kim loại kiềm đều không màu, không tạo kết tủa.
Câu 2. Chọn C.
\(NH_4^ + + O{H^ - } \to N{H_3} \uparrow + {H_2}O\)
Khí làm xanh quỳ ẩm.
Câu 3. Chọn B.
\(\begin{array}{l}A{g^ + } + C{l^ - } \to AgCl\\A{g^ + } + O{H^ - } \to A{g_2}O + {H_2}O\end{array}\)
Câu 4. Chọn C.
\(\begin{array}{l}SO_3^{2 - } + B{a^{2 + }} \to BaS{O_3}\\SO_3^{2 - } + B{r_2} + {H_2}O \to SO_4^{2 - } + 2B{r^ - } + 2{H^ + }\\SO_4^{2 - } + B{a^{2 + }} \to BaS{O_4}\end{array}\)
Câu 5. Chọn D.
\(AlC{l_3}\) tạo kết tủa trắng; \(ZnC{l_2}\) tạo kết tủa trắng tan trong \(N{H_3}\) dư.
\(CuC{l_2}\) tạo kết tủa xanh lam tan trong \(N{H_3}\) dư được dung dịch xanh đậm.
\(Fe{(N{O_3})_3}\) tạo kết tủa nâu đỏ.
Câu 6. Chọn C.
NaOH không xảy ra, HCl cho bọt khí, \({H_2}S{O_4}\) cho bọt khí và kết tủa.
Câu 7. Chọn D.
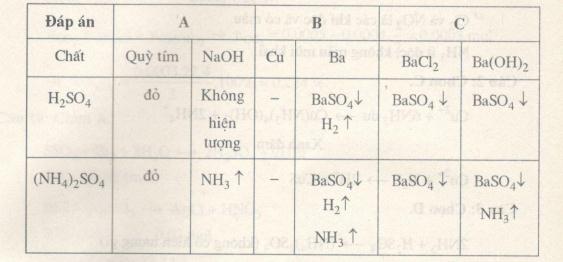
\(NaHC{O_3}\) sủi bọt khí với \({H_2}S{O_4}\), KOH tạo khí với \({(N{H_4})_2}S{O_4}\) bão hòa.
Câu 8. Chọn B.
Câu 9. Chọn D.
A sai: vì dung dịch hòa điện.
B sai: đun nóng dung dịch vẫn dư \(C{a^{2 + }}\) sau phản ứng:
\(C{a^{2 + }} + HCO_3^ - \to CaC{O_3} + {H_2}O + C{O_2}\)
C sai: \(Ca{(OH)_2} + Ca{(HC{O_3})_2} \to CaC{O_3} + {H_2}O\)
Câu 10. Chọn A.
\(5S{O_2} + 2KMn{O_4} + 2{H_2}O \to\)
\({K_2}S{O_4} + 2MnS{O_4} + 2{H_2}S{O_4}\)
\(10FeS{O_4} + 2Mn{O_4} + 8{H_2}S{O_4} \to\)
\(F{e_2}{(S{O_4})_3} + {K_2}S{O_4} + 2MnS{O_4} + 8{H_2}O\)
Dùng dung dịch \(KMn{O_4}\) nhỏ từ từ vào hai dung dịch với tốc độ như nhau. Trường hợp \(FeS{O_4}\) cần ít \(KMn{O_4}\) hơn \( \to \) dung dịch \(FeS{O_4}\) màu tím trước dung dịch \(S{O_2}.\)

