Đề bài
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Cho các dung dịch : HCl,AgNO3,H2SO4 loãng, H2SO4 đặc nguội, Cu(NO3)2,Fe(NO3)2,HNO3 loãng. Số dung dịch co thể dùng (dư) để thu được Ag tinh khiết từ hỗn hợp rắn gồm Ag, CuO, Fe là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 2. Liên kết hóa học trong tinh thể Na là liên kết giữa
A. các cặp electron dùng chung với các hạt nhân
B. toàn bộ electron tự do với các ion duong natri ở các nút mạng
C. các ion dương với các ion âm
D. cả 3 kiểu trên
Câu 3. Dãy nào gồm các chất rắn không tan trong H2O, nhưng tan trong dung dịch H2SO4 loãng dư
A.CuO,Cu,Fe,Cu(OH)2.B.Na,Na2O,Na2CO3,CaCO3C.Fe,FeS,Fe3O4,Fe(OH)2D.Al,Al2O3,CaO,Mg(OH)2
Câu 4. Nhúng các thanh Fe giống nhau cùng lúc vào các dung dịch dưới đây. Trường hợp nào thanh Fe bị ăn mòn nhanh nhất?
A. 200 ml dung dịch H2SO4 0,2M.
B. 200 ml dung dịch H2SO4 0,2 M có cho thêm lượng nhỏ CuSO4.
C. 200 ml dung dịch H2SO4 0,25M.
D. 200 ml dung dịch H2SO4 0,25M có cho thêm lượng nhỏ dung dịch ZnSO4.
Câu 5. Cho các dung dịch: NaOH,HCl,C6H5OH,C6H5NH2,C6H5NH3Cl,Br2 lần lượt tác dụng với nhau từng đôi một. Số phản ứng xảy ra thuộc loại phản ứng axit – bazơ là
A. 1.
B. 3.
C. 6.
D. 4.
Câu 6. Cho sơ đồ
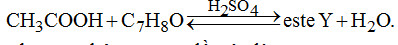
Số công thức cấu tạo của C7H8O chứa vòng benzen thỏa mãn sơ đồ trên là
A. 1.
B. 3.
C. 5.
D. 4.
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1. (2 điểm)
Viết cấu hình eletron của Fe ( Z = 26) và các ion Fe2+,Fe3+. Từ đó cho biết tính chất hóa học cơ bản của chúng. Mỗi trường hợp viết một phương trình minh họa.
Câu 2. (1,5 điểm)
Viết phương trình hóa học xảy ra khi cho glyxin (H2N−CH2−COOH) lần lượt tác dụng với: dung dịch NaOH, dung dịch HCl, C2H5OH có mặt khí HCl bão hòa.
Câu 3. (1,5 điểm)
Este A có công thức phân tử C3H4O2. Thực hiện các phản ứng sau của A:
+ Cho A tác dụng với dung dịch brom.
+ Cho A tác dụng với dung dịch AgNO3 trong NH3
+ Đun A với dung dịch NaOH.
Viết các phương trình hóa học xảy ra ở dạng công thức cấu tạo.
Câu 4. (2 điểm)
Cho 28,8 gam hỗn hợp Cu và Fe2O3 tác dụng với dung dịch H2SO4 loãng dư thu được dung dịch A và 6,4 gam chất rắn không tan.
a) Viết phương trình hóa học xảy ra.
b) Tính thành phần phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Chọn B.
Chỉ dung dịch HCl loãng hoặc H2SO4 loãng dùng dư mới hòa tan hết tạp chất cả CuO và Fe, mà không hoàn tan Ag.
Câu 2. Chọn B.
Liên kết hóa học trong tinh thể Na là liên kết kim loại do toàn bộ electron tự do với các ion dương Na+ ở nút mạng.
Câu 3. Chọn C.
Cu không tan trong cả H2O và dung dịch H2SO4 loãng dư ⇒ loại A.
Na và CaO tan trong cả H2O và dung dịch H2SO4 loãng dư ⇒ loại B và D.
Câu 4. Chọn B.
Fe bị ăn mòn điện hóa (các trường hợp còn lại là ăn mòn hóa học) do:
Fe đẩy Cu (khỏi CuSO4) tạo cặp pin Fe – Cu trong đó Fe là cực âm.
Câu 5. Chọn D.
4 phản ứng là phản ứng axit – bazơ là
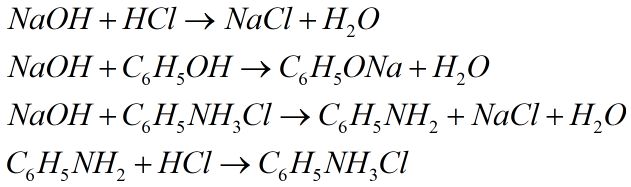
Câu 6. Chọn A.
Chỉ có thể là ancol thơm C6H5CH2OH (duy nhất).
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1. (2 điểm)
Fe:[Ar]3d64s2 chất khử trung bình (tác dụng với dung dịch HCl tạo Fe2+, tác dụng HNO3 tạo Fe3+): Fe+2H+→Fe2++H2
Ion Fe2+:[Ar]3d6 là chất khử (tác dụng với chất oxi hóa Cl2,ddAgNO3,...) hoặc chất oxi hóa (tác dụng với chất khử là kim loại trước Fe: Al, Zn): Fe2++Cl2→Fe3++2Cl−
Ion Fe3+:[Ar]3d5 là chất oxi hóa khá mạnh (tác dụng với chất khử kim loại, KI,…)
Câu 2. (1,5 điểm)
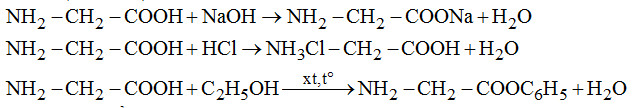
Câu 3. (1,5 điểm)
A là HCOOCH=CH2
(có hai loại chức: este –COO– và chức anđehit –CH=O và liên kết đôi)
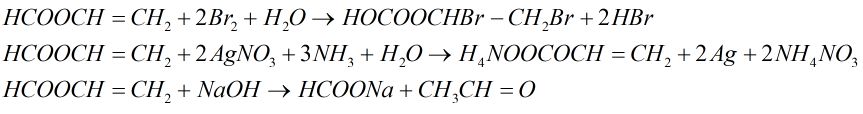
Câu 4. (2 điểm)
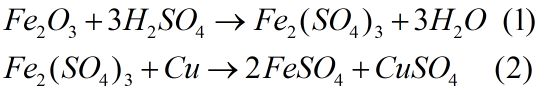
Cu dư 6,4 gam
Theo (1) và (2): số mol Cu tan = số mol Fe2O3 trong hỗn hợp = a
mFe2O3+mCu(tan)=28,8−6,4=22,4160a+64a=22,4⇒a=0,1mol
⇒mCu trong hỗn hợp là 12,8 gam chiếm 44,44% khối lượng còn Fe2O3 chiếm 55,56% khối lượng.

