A. NITƠ
- Cấu hình electron N (Z = 7): 1s22s22p3
=> Vị trí ô thứ 7, chu kì 2 nhóm VA trong bảng tuần hoàn.
- Số oxi hóa có thể có : -3; 0; +1; +2; +3; +4; +5
1. Cấu tạo và tính chất:
- Cấu tạo: N≡N → N2 rất bền
- Ở điều kiện thường N2 là chất khí không màu, không mùi, không vị, không duy trì sự cháy, sự hô hấp.
- Nhiệt độ thường, N2 khá trơ về mặt hóa học.
- Nhiệt độ cao, N2 vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
+ Tính oxi hóa: $\overset{0}{\mathop{{{N}_{2}}}}\,+3Mg\xrightarrow{{{t}^{0}}}M{{g}_{3}}\overset{-3}{\mathop{{{N}_{2}}}}\,$
+ Tính khử: $\overset{0}{\mathop{{{N}_{2}}}}\,+{{O}_{2}}\xrightarrow{{{t}^{0}},xt}2\overset{+2}{\mathop{N}}\,O$
2. Điều chế:
- Trong công nghiệp: chưng cất phân đoạn không khí lỏng.
- Trong PTN: NH4Cl + NaNO2 $\xrightarrow{{{t}^{0}}}$ NaCl + N2↑+ 2H2O
B. AMONIAC (NH3)
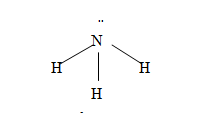
1. Cấu tạo: NH3 là phân tử có cực, có cấu tạo hình chóp:
2. Tính chất vật lý:
- Chất khí không màu, có mùi khai và sốc, nhẹ hơn không khí
thu khí NH3 bằng phương pháp đẩy không khí (úp ngược bình).
- Tan rất nhiều trong nước tạo thành dung dịch NH3 không thu bằng phương pháp dời chỗ của nước.
3. Tính chất hóa học:
Trong phân tử NH3 còn đôi electron tự dó => Có khả năng cho e => NH3 có tính bazơ.
Ngoài ra Trong NH3 Nitơ có số oxi hóa -3 thấp nhất => thể hiện tính khử
- Tính bazơ yếu:
NH3 + H2O \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) NH4+ +OH- (NH3 làm quỳ ẩm chuyển sang màu xanh)
NH3(k) + HCl(k) → NH4Cl(r)
3NH3 + 3H2O + AlCl3 → 3NH4Cl + Al(OH)3 \( \downarrow \)
- Tính tạo phức: dung dịch NH3 có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại (Ag, Cu, Zn)
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
2NH3 + AgCl → [Ag(NH3)2]Cl
- Tính khử:
\(2\mathop N\limits^{ - 3} {H_3} + 3C{l_2} \to \mathop {{N_2}}\limits^0 + 6HCl\)
\(2\mathop N\limits^{ - 3} {H_3} + 3CuO \to \mathop {{N_2}}\limits^0 + 3{H_2}O + 3Cu\)
4. Điều chế:
Cho muối amoni tác dụng với dung dịch bazơ
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
C. MUỐI AMONI (NH4Cl, NH4NO3, (NH4)2SO4…)
- Tác dụng với dung dịch kiềm
NH4+ + OH- → NH3 \( \uparrow \) + H2O (phản ứng này dùng để nhận biết ion NH4+ )
- Phản ứng nhiệt phân: Các muối amoni dễ bị nhiệt phân
+) Muối amoni mà gốc axit không còn khả năng oxi hóa nhiệt phân tạo NH3 :
(NH4)2CO3 $\xrightarrow{{{t}^{0}}}$ 2NH3 + CO2 + H2O
+) Muối amoni mà gốc axit có khả năng oxi hóa nhiệt phân tạo N2 hoặc N2O:
$\overset{-3}{\mathop{N}}\,{{H}_{4}}N{{O}_{2}}\xrightarrow{{{t}^{0}}}\overset{0}{\mathop{{{N}_{2}}}}\,+2{{H}_{2}}O$
$\overset{-3}{\mathop{N}}\,{{H}_{4}}N{{O}_{3}}\xrightarrow{{{t}^{0}}}\overset{+1}{\mathop{{{N}_{2}}}}\,O+2{{H}_{2}}O$
D. AXIT NITRIC (HNO3)
1. Tính axit mạnh:
- Làm đỏ quỳ tím.
- Tác dụng với bazơ, oxit bazơ, muối
2. Tính oxi hóa mạnh: HNO3 oxi hóa hầu hết các kim loại kể cả những kim loại đứng sau H như Cu, Ag (trừ Pt, Au), oxi hóa kim loại lên số oxi hóa dương cao nhất, oxi hóa nhiều phi kim và hợp chất.
Sản phẩm khử: thông thường là NO ngoài ra còn có thể là \(N{O_2}\), N2, N2O, (NH4NO3)
\(\mathop {Cu}\limits^0 \) + 4HNO3(đặc) → \(\mathop {Cu}\limits^{ + 2} {\left( {N{O_3}} \right)_2}\) + 2NO2↑ + 2H2O
\(\mathop {Fe}\limits^0 \) + 4HNO3(loãng) →\(\mathop {Fe}\limits^{ + 3} {(N{O_3})_3}\) + NO↑ + 2H2O
\(S + 2H\mathop N\limits^{ + 5} {O_3} \to {H_2}S{O_4} + 2\mathop N\limits^{ + 2} O\)
\(3\mathop {Fe}\limits^{ + 2} O + 10H\mathop N\limits^{ + 5} {O_3} \to 3\mathop {Fe}\limits^{ + 3} {(N{O_3})_3} + \mathop N\limits^{ + 2} O + 5{H_2}O\)
* Fe, Al, Cr thụ động với HNO3 đặc, nguội.
3. Điều chế:
- Trong PTN: NaNO3(tinh thể) + H2SO4(đặc) → NaHSO4 + HNO3
- Trong công nghiệp: NH3 $\xrightarrow{+{{O}_{2}}}$ NO$\xrightarrow{+{{O}_{2}}}$ NO2$\xrightarrow{+{{O}_{2}}+{{H}_{2}}O}HN{{O}_{3}}$
E. MUỐI NITRAT ( Chứa ion NO3-)
1. Tính chất hóa học
- Dễ bị phân hủy bởi nhiệt
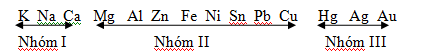
Nhóm I nhiệt phân tạo muối nitrơ và O2: Ví dụ: 2KNO3 $\xrightarrow{{{t}^{o}}}$ 2KNO2 + O2↑
Nhóm II nhiệt phân tạo oxit, NO2 và O2: Ví dụ: 2Cu(NO3)2 $\xrightarrow{{{t}^{o}}}$2CuO + 4NO2 ↑+ O2↑
Nhóm III nhiệt phân tạo kim loại, NO2 và O2: Ví dụ: 2AgNO3$\xrightarrow{{{t}^{o}}}$2Ag + 2NO2 ↑+ O2↑
- Nhận biết ion NO3- : sử dụng: Cu + H2SO4 (hoặc HCl)
3Cu +8 H+ + 2NO3- → 3Cu2+ + 2NO $\uparrow $ + 4H2O(xuất hiện dd xanh lam và khí không màu hóa nâu)
2. Ứng dụng:
- Thuốc nổ đen(thuốc nổ có khói): KNO3 + S +C
F. PHOTPHO
1. Tính chất vật lí
- Photpho trắng: Rất độc, gây bỏng nặng khi rơi vào da, ở nhiệt độ thường phát quang màu lục nhạt trong bóng tối, bốc cháy trong không khí ở nhiệt độ > 400C
- Photpho đỏ: Là chất bột màu đỏ, dễ hút ẩm và chảy rữa, cấu trúc polime → khó nóng chảy và khó bay hơi hơn photpho trắng, không tan trong các dung môi thông thường, bền trong không khí ở nhiệt độ thường, bốc cháy ở nhiệt độ > 2500C
P trắng $\xrightarrow{{{250}^{0}}C}$ P đỏ
2. Tính chất hóa học
Photpho hoạt động hóa học mạnh hơn nitơ
- Tính oxi hóa:
P + kim loại hoạt động → photphua kim loại
VD: $\overset{0}{\mathop{P}}\,+Ca\xrightarrow{{{t}^{0}}}C{{a}_{3}}\overset{-3}{\mathop{P}}\,$ (Canxi photphua)
- Tính khử:
|
P + oxi: 4$\overset{0}{\mathop{P}}\,$ + 3O2(thiếu) $\xrightarrow{{{t}^{0}}}$ 2${{\overset{+3}{\mathop{P}}\,}_{2}}{{O}_{3}}$ 4$\overset{0}{\mathop{P}}\,$ + 5O2(thiếu) $\xrightarrow{{{t}^{0}}}$ 2${{\overset{+5}{\mathop{P}}\,}_{2}}{{O}_{5}}$ |
P + halogen: 2$\overset{0}{\mathop{P}}\,$ + 3Cl2(thiếu) $\xrightarrow{{{t}^{0}}}$ 2$\overset{+3}{\mathop{P}}\,C{{l}_{3}}$ 2$\overset{0}{\mathop{P}}\,$ + 5Cl2(thiếu) $\xrightarrow{{{t}^{0}}}$ 2$\overset{+5}{\mathop{P}}\,C{{l}_{5}}$ |
P + hợp chất (HNO3 đặc, KClO3, KNO3, K2Cr2O7,….) $\begin{align}& 6\overset{0}{\mathop{P}}\,+5KCl{{O}_{3}}\xrightarrow{{{t}^{0}}}3\overset{+5}{\mathop{{{P}_{2}}}}\,{{O}_{5}}+5KCl \\& \overset{0}{\mathop{P}}\,+5HN{{O}_{3}}\xrightarrow{{{t}^{0}}}{{H}_{3}}\overset{+5}{\mathop{P}}\,{{O}_{4}}+5N{{O}_{2}}\uparrow +{{H}_{2}}O \\\end{align}$ |
3. Ứng dụng:
- Sản xuất axit photphoric
- Sản xuất diêm, bom, đạn…
4. Trạng thái tự nhiên:
- Dạng muối photphoric như apatit 3Ca3(PO4)2.CaF2, photphorit Ca3(PO4)2
5. Sản xuất:
Ca3(PO4)2 + 3SiO2 + 5C $\xrightarrow{{{120}^{0}}}$ 3CaSiO3 + 2P + 5CO
G. AXIT PHOTPHORIC (H3PO4)
1. Tính chất vật lí
- Là chất rắn dạng tinh thể, trong suốt, không màu, rất háo nước => dễ chảy rữa
- Axit photphoric thường dùng là dung dịch đặc, sánh
2. Tính chất hóa học:
- Tính oxi hóa – khử:
Photpho có mức oxi hóa +5 bền hơn nitơ => axit H3PO4 khó bị khử => không có tính oxi hóa như axit HNO3
- Tính axit:
+ Axit H3PO4 là axit ba lần axit, có độ mạnh trung bình => Có đầy đủ tính chất chung của axit
+ Tác dụng với bazơ: Sản phẩm tạo thành phụ thuộc vào x
Đặt x=\(\frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}}\)
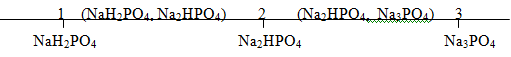
3. Điều chế
- Trong phòng thí nghiệm: P + 5HNO3(đặc) $\xrightarrow{{{t}^{0}}}$H3PO4 + 5NO2 ↑ + H2O
- Trong công nghiệp: Ca3(PO4)2 + 3H2SO4(đặc) $\xrightarrow{{{t}^{0}}}$ 3CaSO4↓ + 2H3PO4
=> H3PO4 không tinh khiết, có chất lượng thấp
P $\xrightarrow{{{t}^{0}}}$ P2O5 → 2H3PO4 => H3PO4 có độ tinh khiết và nồng độ cao
H. MUỐI PHOTPHAT (PO43-)
1. Tính tan:
- Tất cả các muối đihiđrophotphat đều tan trong nước
- Muối photphat trung hòa và muối hiđrophotphat: trừ muối Na+, K+, NH4+ là dễ tan, còn lại đều không tan hoặc ít tan trong nước.
Na3PO4 tạo từ kim loại mạnh và gốc axit yếu => Dung dịch Na3PO4 có môi trường kiềm
2. Nhận biết ion photphat:
Dùng thuốc thử AgNO3 : 3Ag+ + PO43- → Ag3PO4 \( \downarrow \) màu vàng
3. PHÂN BÓN HÓA HỌC
Phân đạm: Độ dinh dưỡng = %N
VD: NH4NO3
Độ dinh dưỡng\( = \frac{{2.14}}{{80}}.100\% = 35\% \)
Phân lân: Độ dinh dưỡng = %P2O5
VD: Ca(H2PO4)2
Độ dinh dưỡng= \(\frac{{142}}{{40 + (2 + 31 + 16.4).2}}.100\% \approx 60,7\% \)
Phân kali: Độ dinh dưỡng = %K2O
VD: KNO3
Độ dinh dưỡng\( = \frac{{1/2.(39.2 + 16)}}{{39 + 62}}.100\% \approx 46,5\% \)

