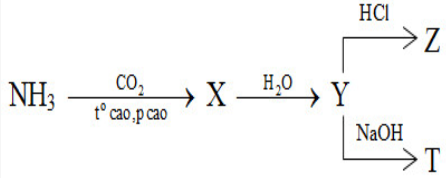
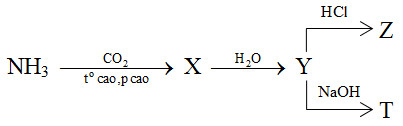I. AMONIAC (NH3)
1. Cấu tạo và tính chất vật lí
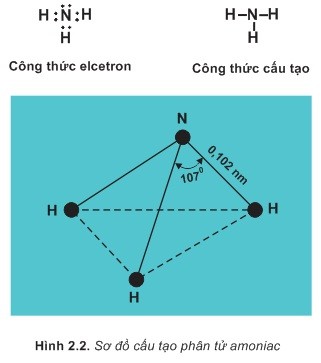
- Là chất khí không màu, mùi khai và xốc, tan rất nhiều trong nước.
2. Tính chất hóa học
a. Tính bazơ yếu (do cặp e chưa tham gia liên kết ở nguyên tử N)
Ba(OH)2 > NaOH > NH3 > Mg(OH)2 > Al(OH)3
+ Phản ứng với nước: NH3 + H2O ⇆ NH4+ + OH-
Dung dịch NH3 làm cho quỳ tím ẩm chuyển màu xanh, phenolphtalein chuyển màu hồng.
+ Phản ứng với axit :
NH3 (k) + HCl (k) → NH4Cl (khói trắng)
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
+ Tác dụng với dung dịch muối của các kim loại mà hiđroxit không tan → bazơ và muối:
2H2O + 2NH3 + MgCl2 → Mg(OH)2 + 2NH4Cl
Chú ý: Với muối của Cu2+, Ag+ và Zn2+ có kết tủa sau đó kết tủa tan do tạo phức chất tan [Cu(NH3)4](OH)2; [Ag(NH3)2]OH; [Zn(NH3)4](OH)2
Ví dụ: CuSO4 + 2NH3 + 2H2O → Cu(OH)2 ↓ xanh + (NH4)2SO4
NH3 dư thì : Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 dung dịch xanh thẫm
b. Tính khử mạnh (do N trong NH3có mức oxi hóa thấp nhất -3)
- Tác dụng với O2 :
4N{{H}_{3}}~+\text{ }3{{O}_{2}}~\xrightarrow{{{t}^{0}}}~2{{N}_{2}}~+\text{ }6{{H}_{2}}O
4N{{H}_{3}}~+\text{ }5{{O}_{2}}~\xrightarrow{{{t}^{0}},xt}4NO\text{ }+\text{ }6{{H}_{2}}O
- Tác dụng với Cl2
2NH3 + 3Cl2 → N2 + 6HCl
NH3 khí + HClkhí → NH4Cl (khói trắng)
- Tác dụng với oxit của kim loại : 3CuO đen + 2NH3 \xrightarrow{{{t}^{0}}}3Cu đỏ + N2 + 3H2O
3. Điều chế
- Trong công nghiệp: tổng hợp từ N2 và H2 : N2 + 3H2 \overset{{{t}^{0}},xt}{\leftrightarrows} 2NH3
- Trong phòng thí nghiệm:
+ Cho muối amoni tác dụng với dung dịch kiềm:
NH4Cl + NaOH → NaCl + NH3 ↑+ H2O
+ Nhiệt phân muối amoni
NH4Cl \xrightarrow{{{t}^{0}}} NH3↑ + HCl
NH4HCO3 \xrightarrow{{{t}^{0}}} NH3 ↑ + H2O + CO2
4. Ứng dụng
- Sản xuất axit nitric, các loại phân đạm;
- Điều chế hiđrazin làm nhiên liệu cho tên lửa.
- Amoniac lỏng được dùng làm chất gây lạnh trong máy lạnh.
II. PHƯƠNG PHÁP GIẢI BÀI TẬP PHẢN ỨNG ĐIỀU CHẾ NH3
PTHH : N2 + 3H2 \overset{{{t}^{0}},xt,p}{\leftrightarrows} 2NH3
- Hằng số của phản ứng tổng hợp NH3: {{K}_{c}}=\frac{{{\left[ N{{H}_{3}} \right]}^{2}}}{\left[ {{N}_{2}} \right]{{\left[ {{H}_{2}} \right]}^{3}}}
Phương pháp giải:
Bước 1 : Tính số mol ( hoặc thể tích) N2 và H2 ban đầu.
Bước 2 : Căn cứ vào tỉ lệ mol của N2 và H2 để xác định hiệu suất xem hiệu suất tính theo chất nào (tính theo chất thiếu).
Bước 3 : Xét số mol ( thể tích) các chất tại 3 mốc quan trọng:
+ Số mol ( thể tích) của các chất ban đầu.
+ Số mol( thể tích) các chất phản ứng.
+ Số mol ( thể tích) các chất khi cần bằng.
Bước 4 : Sử dụng những dự kiện còn lại để tính toàn kết quả của bài tập.
Ta có thể sử kết hợp một số phương pháp giải nhanh như:
+ Bảo toàn khối lượng ( khối lượng hỗn hợp khí trước và sau phản ứng bằng nhau).
+ Tăng giảm số mol khí ({{n}_{kh\acute{i}\text{ }giảm}}=2{{n}_{{{N}_{2}}\text{ }pứ}}=\frac{2}{3}{{n}_{{{H}_{2}}\,\,pứ}}={{n}_{N{{H}_{3}}\,\,sinh\text{ }ra}})
+ Nếu đề bài cho Mtrung bình của hỗn hợp N2 và H2 ta có thể sử dụng quy tắc đường chéo để xác định tỉ lệ mol (tỉ lệ thể tích) của H2 và N2.
+ Nếu đề không cho số mol hay thể tích mà chỉ cho tỉ lệ mol (thể tích) thì ta tự chọn lượng chất ban đầu bằng đúng tỉ lệ mol của N2 và H2.