I. ĐỊNH NGHĨA, PHÂN LOẠI
1. Định nghĩa
Axit cacboxylic là hợp chất hữu cơ mà phân tử có nhóm –COOH liên kết với gốc hiđrocacbon, với H hoặc với nhau.
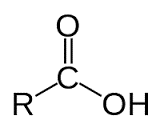
- Công thức tổng quát của axit:
+ CxHyOz (x, y, z là các số nguyên dương; y chẵn; z chẵn; 2 ≤ y ≤ 2x + 2 – 2z) : thường dùng khi viết phản ứng cháy.
+ CxHy(COOH)z hay R(COOH)z: thường dùng khi viết phản ứng xảy ra ở nhóm COOH.
+ CnH2n+2-2k-z(COOH)z (k = số liên kết pi + số vòng): thường dùng khi viết phản ứng cộng H2, cộng Br2,…
2. Phân loại
- Dựa vào cấu tạo gốc hiđrocacbon: axit no, không no, thơm.
- Dựa vào số nhóm –COOH: axit đơn chức, đa chức.
a. Axit no, đơn chức, mạch hở : CnH2n+1COOH (n ≥ 0) hoặc CmH2mO2 (m ≥ 1).
b. Axit không no chứa 1 liên kết đôi C=C, đơn chức, mạch hở: CnH2n-1COOH (n ≥ 2) hoặc CmH2m-2O2 (m ≥ 3).
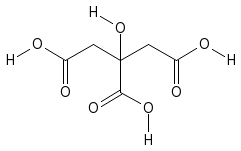
c. Axit no, 2 chức, mạch hở: CnH2n(COOH)2 (n ≥ 0) hoặc CmH2m-2O4 (m ≥ 1).
II. DANH PHÁP
1. Tên thay thế
Tên thay thế = Axit + Tên hiđrocacbon tương ứng theo mạch chính (mạch chính bắt đầu từ nguyên tử C của nhóm –COOH) + oic
2. Tên thường của một số axit thường gặp
|
Axit cacboxylic |
Tên axit cacboxylic |
Axit cacboxylic |
Tên axit cacboxylic |
|
HCOOH |
Axit fomic |
(CH2)3(COOH)2 |
Axit glutaric |
|
CH2=CH-COOH |
Axit acrylic |
(CH2)4(COOH)2 |
Axit ađipic |
|
(COOH)2 |
Axit oxalic |
C15H31COOH |
Axit panmitic |
|
CH2=C(CH3)-COOH |
Axit metacrylic |
C17H35COOH |
Axit stearic |
|
C6H5-COOH |
Axit benzoic |
C17H33COOH |
Axit oleic |
|
CH2-(COOH)2 |
Axit Malonic |
C17H31COOH |
Axit linoleic |
|
(CH2-COOH)2 |
Axit Succinic |
|
|
III. TÍNH CHẤT VẬT LÍ
1. Nhiệt độ sôi
- Ở điều kiện thường, các axit cacboxylic đều là những chất lỏng hoặc rắn.
- Axit có nhiệt độ sôi cao hơn ancol có khối lượng phân tử tương đương vì phân tử axit tạo được 2 liên kết hiđro và liên kết hiđro giữa các phân tử axit bền hơn liên kết hiđro giữa các phân tử ancol.
2. Tính tan
- Từ C1 đến C3 tan vô hạn trong nước do có khả năng tạo liên kết H liên phân tử với nước.
- C4 đến C5 ít tan trong nước; từ C6 trở lên không tan do gốc R cồng kềnh và có tính kị nước.