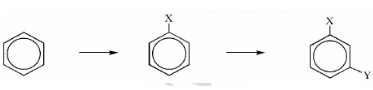
I. CẤU TRÚC, ĐỒNG ĐẲNG, ĐỒNG PHÂN VÀ DANH PHÁP
1. Cấu trúc của phân tử benzen
Có hai cách biểu diễn cấu tạo của benzen :
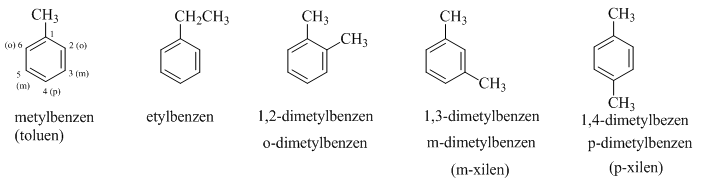
2. Đồng đẳng, đồng phân và danh pháp
Khi thay các nguyên tử hiđro trong phân tử benzen (C6H6) bằng các nhóm ankyl, ta được các ankylbenzen, có công thức chung là CnH2n-6 với n ≥ 6.
Ví dụ : C6H5–CH3; C6H5–CH2–CH3; C6H5–CH2–CH2-CH3
Khi coi vòng benzen là mạch chính thì các nhóm ankyl đính với nó là mạch nhánh (còn gọi là nhóm thế). Ankylbenzen có đồng phân mạch cacbon. Để gọi tên chúng, phải chỉ rõ vị trí các nguyên tử C của vòng bằng các chữ số hoặc các chữ cái o, m, p (đọc là ortho, meta, para).
II. TÍNH CHẤT VẬT LÍ
- Benzen và ankylbenzen là những chất không màu, hầu như không tan trong nước nhưng tan trong nhiều dung môi hữu cơ, đồng thời cũng là dung môi hoà tan nhiều chất khác.
- Các aren (benzen và ankylbenzen) đều là những chất có mùi. Chẳng hạn như benzen và toluen có mùi thơm nhẹ, nhưng có hại cho sức khoẻ, nhất là benzen.
III. TÍNH CHẤT HOÁ HỌC
1. Phản ứng thế
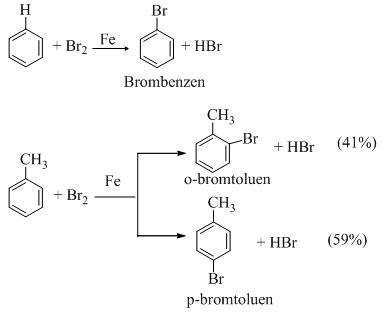
a. Phản ứng halogen hoá
- Khi có bột sắt, benzen tác dụng với brom khan tạo thành brombenzen và khí hiđro bromua.
- Toluen phản ứng nhanh hơn benzen và tạo ra hỗn hợp hai đồng phân ortho và para.
- Nếu không dùng Fe mà chiếu sáng (as) thì Br thế cho H ở nhánh.
Nhóm C6H5CH2 gọi là nhóm benzyl, nhóm C6H5 gọi là nhóm phenyl.
b. Phản ứng nitro hoá
Benzen tác dụng với hỗn hợp HNO3 đặc và H2SO4 đậm đặc tạo thành nitrobenzen :
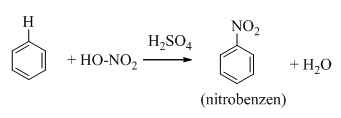
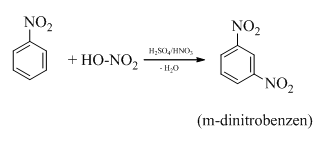
Nitrobenzen tác dụng với hỗn hợp axit HNO3 bốc khói và H2SO4 đậm đặc đồng thời đun nóng thì tạo thành m-đinitrobenzen.
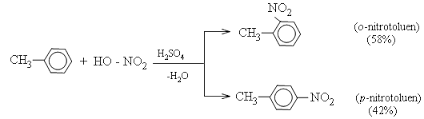
Toluen tham gia phản ứng nitro hoá dễ dàng hơn benzen và tạo thành sản phẩm thế vào vị trí ortho và para :
c. Quy luật thế ở vòng benzen
- Nếu vòng benzen đã có sẵn các nhóm –CH3, –OH, –NH2, –OCH3 …, phản ứng thế vào vòng sẽ dễ dàng hơn và ưu tiên xảy ra ở vị trí ortho và para.
- Nếu ở vòng benzen đã có sẵn nhóm –NO2 (hoặc các nhóm –COOH, –SO3H, –CHO …) phản ứng thế vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí meta.
2. Phản ứng cộng
- Benzen và ankylbenzen không làm mất màu dung dịch brom (không cộng với brom).
- Benzen cộng với clo khi chiếu sáng: C6H6+ 3Cl2as→C6H6Cl6
- Benzen và ankylbenzen cộng với hiđro tạo thành xicloankan: C6H6+3H2Ni,to→C6H12
3. Phản ứng oxi hoá
- Benzen không tác dụng với KMnO4 (không làm mất màu dung dịch KMnO4).
- Các ankylbenzen khi đun nóng với dung dịch KMnO4 thì chỉ có nhóm ankyl bị oxi hoá.
Ví dụ :
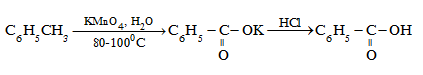
- Các aren khi cháy trong không khí thường tạo ra nhiều muội than. Khi aren cháy hoàn toàn thì tạo ra CO2, H2O và toả nhiều nhiệt. Thí dụ : C6H6 + 152O2 → 6CO2 + 3H2O (ΔH = -3273kJ)
* Nhận xét chung : Benzen tương đối dễ tham gia phản ứng thế, khó tham gia phản ứng cộng và bền vững với các chất oxi hoá. Đó cũng là tính chất hoá học đặc trưng chung của các hiđrocacbon thơm nên được gọi là tính thơm.
IV. ĐIỀU CHẾ VÀ ỨNG DỤNG
1. Điều chế
- Benzen, toluen, xilen… thường tách được bằng cách chưng cất dầu mỏ và nhựa than đá. Chúng còn được điều chế từ ankan, hoặc xicloankan.
- Etylbenzen được điều chế từ benzen và etilen :
CH3[CH2]4CH3 xt,t0→−4H2 C6H6
CH3[CH2]5CH3 xt,t0→−4H2 C6H5CH3
C6H6 + CH2=CH2 xt,t0→C6H5CH2CH3
2. Ứng dụng
- Benzen được dùng để tổng hợp các monome trong sản xuất polime làm chất dẻo, cao su, tơ sợi. Từ benzen người ta điều chế ra nitrobenzen, anilin, phenol dùng để tổng hợp phẩm nhuộm, dược phẩm, thuốc trừ dịch hại,...
- Toluen được dùng để sản xuất thuốc nổ TNT (trinitrotoluen).
- Benzen, toluen và các xilen còn được dùng nhiều làm dung môi.