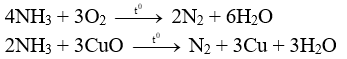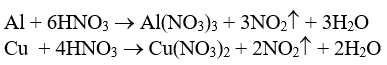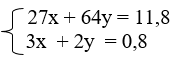Tiết 22- KIỂM TRA 1 TIẾT
I. MỤC TIÊU
1. Kiến thức- Kiểm tra khả năng tiếp thu kiến thức của học sinh về nitơ, photpho và hợp chất của chúng, phân bón hoá học
2. Kĩ năng- Kiểm tra kĩ năng viết phương trình hoá học, vận dụng tính chất hoá học của các chất giải bài tập về axit photphoric, axit nitric ...
3. Thái độ: Giúp HS yêu thích môn học
4. Năng lực cần hướng tới
- Năng lực giải bài tập hh
- Năng lực sd ngôn ngữ hh
- Năng lực sd kt hh vào giải quyết các tình huống thực tiễn
II. HÌNH THỨC : Cả trắc nghiệm và tự luận
III. MA TRẬN
|
Biết |
Hiểu |
Vận dụng |
Tổng |
|||||||
|
TN |
TL |
TN |
TL |
TN |
TL |
|||||
|
1.Nitơ |
- Tính chất vật lý của nitơ - Điều chế nitơ trong công nghiệp |
-Nitơ có tính khử và tính oxi hóa |
||||||||
|
Số câu Số điểm Tỉ lệ (%) |
01 0,5 5,0 |
01 0,5 5,0 |
||||||||
|
2.Amoniac – Muối amoni |
- Tính chất vật lý của amoniac - Dung dịch amoniac có tính bazo yếu làm quỳ tím chuyển sang xanh - Tính tan của muối amoni - Ứng dụng của amoniac, muối amoni |
- Amoniac có tính bazơ khi pư với axit và có tính khử khi phản ứng với chất oxi hóa - Tính chất hóa học của muối amoni |
Nhận biết muối NH4Cl, NH4NO3, (NH4)2SO4 |
|||||||
|
Số câu Số điểm Tỉ lệ (%) |
02 1,0 10,0 |
01 2,0 20,0 |
03 3,0 30,0 |
|||||||
|
3. Axit nitric – Muối nitrat |
-Tính chất vật lý của axit nitric - Ứng dụng của axit nitric |
- Tính axit và tính oxi hóa của axit nitric - Điều chế axit nitric trong công nghiệp -Nhiệt phân muối nitrat |
Hỗn hợp kim loại phản ứng với dd HNO3. Tính % mỗi kim loại |
|||||||
|
Số câu Số điểm Tỉ lệ (%) |
01 0,5 5,0 |
01 3,0 30,0 |
02 3,5 35,0 |
|||||||
|
4. Axit photphoric – Muối photphat |
- Axit photphoric là axit trung bình, điện li theo 3 nấc - Tính tan của muối photphat |
- Tính chất hóa học của axit photphoric - Điều chế axit photphoric trong công nghiệp |
Phản ứng của axit photphoric với dung dịch kiềm (tính tỉ lệ mol). Dung dịch thu được có chất nào tính hàm lượng hoặc nồng độ các chất đó |
|||||||
|
Số câu Số điểm Tỉ lệ (%) |
01 0,5 5,0 |
01 0,5 5,0 |
||||||||
|
5. Phân hóa học |
Phân đạm, lân và kali được đánh giá theo tỉ lệ % của chất nào |
Tính hàm lượng nitơ có trong một số loại phân đạm |
||||||||
|
Số câu Số điểm Tỉ lệ (%) |
01 0,5 5,0 |
01 0,5 5,0 |
||||||||
|
6. Tổng hợp chương |
- Nhận biết - Điều chế - Hoàn thành sơ đồ phản ứng |
|||||||||
|
Số câu Số điểm Tỉ lệ (%) |
01 2,0 20,0 |
01 2,0 20,0 |
||||||||
|
Tổng số câu Tổng điểm Tỉ lệ (%) |
06 3,0 30,0 |
01 2,0 20,0 |
01 2,0 20,0 |
01 3,0 30,0 |
09 10,0 100,0 |
|||||
IV. ĐỀ BÀI
ĐỀ 01 :
Phần I : Trắc nghiệm:
1, Cấu hình e lớp ngoài cùng của nguyên tố N là :
A . 2s22p3 B . 3s23p3 C . 4s24p3 D .5s25p3
2, Hóa trị cao nhất của các nguyên tố nhóm VA trong hợp chất với oxi là :
A . 1 B . 3 C . 5 D . 7
3, Nguyên tố hóa học nào trong nhóm VA có độ âm điện lớn nhất ?
A . O B . N C . P D . S
4, Tại sao nguyên tố N lại hoạt động hóa học kém hơn nguyên tố P ?
A .Vì N trơ về mặt hóa học ở điều kiện thường
B . Vì độ âm điện của N > P
C .Vì độ âm điện của N < P
D .Vì phân tử N có liên kết ba bền vững
5, Nhỏ từ từ từng giọt dd amoniac cho đến dư vào dd muối sắt (II) sunfat , hiện tượng gì sẽ xảy ra ?
A . Không có hiện tượng gì xảy ra
B . Có kết tủa màu lam nhạt
C . Có kết tủa lam nhạt , sau đó tan dần
D . Có kết tủa màu vàng
6, Cho dd axit photphoric tác dụng với amoniac theo tỉ lệ 1/1 , sẽ tạo ra :
A . Amoni đihiđrôphotphatB . Amoni hiđrôphotphat
C . Amoni photphat
D . Không xác định được
Phần II : Tự luận
Câu 1 : Hoàn thành các PTHH sau :
1,N2 + Mg --->
2,NH3 + H2SO4 --->
3,NH4Cl + Ba(OH)2 --->
4,HNO3 + CuO --->
5,HNO3 + Fe ---> NO2 +...
6,Na3PO4 + Ca(NO3)2 --->
Câu 2 : Hòa tan hoàn toàn 24,8 gam hỗn hợp kim loại Cu & Fe bằng 2 lit dd HNO3 1M , thu được dd X và giải phóng 6,72 lít khí NO (đktc)
a, Tính thành phần % về khối lượng của các kim loại có trong hỗn hợp ban đầu ?
b, Tính nồng độ mol/l của dd X ?
Câu 3 : Nhiệt phân hoàn toàn 36,7 gam hỗn hợp rắn A gồm 2 muối NaNO3 & Cu(NO3)2 , thu được 9,52 lit hỗn hợp khí (đktc)
a, Viết PTHH của các phản ứng xảy ra ?
b, Tính thành phần % về khối lượng của mối muối trong hỗn hợp A ?
ĐỀ 02 :
Phần I : Trắc nghiệm:
1, Cấu hình e lớp ngoài cùng của nguyên tố P là :
A . 2s22p3 B . 3s23p3 C . 4s24p3 D .5s25p3
2, Hóa trị của các nguyên tố nhóm VA trong hợp chất với Hiđrô là :
A . 1 B . 3 C . 5 D . 7
3, Nguyên tố hóa học nào trong nhóm VA có độ âm điện nhỏnhất ?
A . As B . N C . P D . Sb
4, Khi trời mưa giông , chất nào được tạo thành ?
A . Oxit cacbon B . Oxit lưu huỳnh C . Oxit nitơ D . Không có chất gì
5, Nhỏ từ từ từng giọt dd amoniac cho đến dư vào dd muối natri nitrat , hiện tượng gì sẽ xảy ra ?
A . Không có hiện tượng gì xảy ra
B . Có kết tủa màu xanh lam
C . Có kết tủa trắng , sau đó tan dần
D . Có kết tủa màu trắng
6, Cho dd axit photphoric tác dụng với amoniac theo tỉ lệ 2/1 , sẽ tạo ra :
A . Amoni đihiđrôphotphat
B . Amoni hiđrôphotphat
C . Amoni photphat
D . Không xác định được
Phần II : Tự luận
Câu 1 : Hoàn thành các PTHH sau :
1,N2 + Al--->
2,NH3 + HNO3--->
3,NH4NO3 + Ca(OH)2--->
4,HNO3 + Fe2O3--->
5,HNO3 + Cu---> NO +...
6,(NH4)3PO4 + Ba(NO3)2
Câu 2 : Hòa tan hoàn toàn 6,3 gam hỗn hợp kim loại Mg & Al bằng 1 lit dd HNO3 3M , thu được dd X và giải phóng 4,48 lít khí NO (đktc)
a, Tính thành phần % về khối lượng của các kim loại có trong hỗn hợp ban đầu ?
b, Tính nồng độ mol/l của dd X ?
Câu 3 : Nhiệt phân hoàn toàn 34,05 gam hỗn hợp rắn A gồm 2 muối KNO3 & Zn(NO3)2 , thu được 7,28 lit hỗn hợp khí (đktc)
a, Viết PTHH của các phản ứng xảy ra ?
b, Tính thành phần % về khối lượng của mối muối trong hỗn hợp A ?
V. HƯỚNG DẪN CHẤM
PHẦN I. TRẮC NGHIỆM:
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
|
Đáp án |
D |
A |
B |
C |
A |
C |
PHẦN II. TỰ LUẬN:
|
Câu hỏi |
Nội dung và hướng dẫn chấm |
Điểm |
|
Câu 1 (2,0 đ) |
Lấy 2 ví dụ về tính khử của NH3 :
Lấy 2 ví dụ về tính bazơ của NH3 : NH3 + HCl → NH4Cl 2NH3 + MgCl2 + 2H2O → 2NH4Cl + Mg(OH)2↓ |
0,5 0,5 0,5 0,5 |
|
Câu 2 (2,0 đ) |
- Dùng AgNO3 nhận biết đc NaCl cho kết tủa màu trắng, nhận biết được Na3PO4 cho kết tủa màu vàng - Dùng HCl nhận biết được Na2CO3 vì tạo khí bay lên - Còn lại là NaNO3 |
0,5 0,5 0,5 0,5 |
|
Câu 3 (3,0 đ) |
a)
|
0,5 0,5 |
|
b) Từ đề bài và pthh ta có hệ pt :
Giải hệ pt được x= 0,2 ; y= 0,1 Khối lượng Al = 5,4 gam ứng với 45,76%. Khối lượng Cu = 6,4 gam ứng với 54,24%. |
0,5 0,5 0,5 |
|
|
c) Số mol HNO3 = 6x + 4y = 1,6 mol => CM = 4(M). |
0,5 |
VI. TIẾN TRÌNH DẠY HỌC :
1, Ổn định tổ chức : Kiểm tra sĩ số, đồng phục...
|
Lớp dạy |
|
|
Ngày dạy |
|
|
Sĩ số |
2. Phát đề kiểm tra
3. Coi kiểm tra :
4. Thu bài & nhận xét giờ kiểmtra
·Kết quả kiểm tra:
|
Lớp |
0→<3 |
3→<5 |
5→<6,5 |
6,5→<8 |
8→10 |