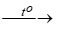Tiết 26 .Bài 17 : SILIC VÀ HỢP CHẤT CỦA SILIC
I. MỤC TIÊU BÀI HỌC
1. Kiến thức: Biết được:
- Vị trí của silic trong bảng tuần hoàn các nguyên tố hoá học, cấu hình electronnguyên tử.
- Tính chất vật lí (dạng thù hình, cấu trúc tinh thể, màu sắc, chất bán dẫn), trạng thái tự nhiên , ứng dụng (trong kĩ thuật điện), điều chế silic (Mg + SiO2).
- Tính chất hoá học : Là phi kim hoạt động hoá học yếu,ở nhiệt độ cao tác dụng với nhiều chất (oxi, cacbon, dung dịch NaOH, magie).
- SiO2: Tính chất vật lí (cấu trúc tinh thể, tính tan), tính chất hoá học (tác dụng với kiềm đặc, nóng, với dung dịch HF).
- H2SiO3 : Tính chất vật lí (tính tan, màu) sắc, tính chất hoá học ( là axit yếu, ít tan trong nước, tan trong kiềm nóng).
2. Kĩ năng:
- Viết được các PTHH thể hiện tính chất của silic và các hợp chất của nó.
- Tính % khối lượng SiO2 trong hỗn hợp.
3.Thái độ : Có thái độ học tập tích cực , chủ động
4. Năng lực cần hướng tới :
- Năng lực chung : tự học ; giao tiếp ;hợp tác ; tư duy logic, so sánh và tổng hợp ; vận dụng kiến thức hóa học vào thực tiễn
- Năng lực riêng : tư duy hóa học ;sử dụng ngôn ngữ hóa học ;tính toán hóa học
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Giáo viên: Giáo án ; Bảng tuần hoàn các nguyên tố hóa học
2. Học sinh: Đọc trước bài mới.
III. TIẾN TRÌNH BÀI GIẢNG
1, Ổn định tổ chức : Kiểm tra sĩ số, đồng phục...
|
Lớp dạy |
|
|
Ngày dạy |
|
|
Sĩ số |
2. Kiểm tra bài cũ: Trong giờ học
3. Bài mới:
3.1.Khởi động : Ở các bài trước , chúng ta đã cùng tìm hiểu về nguyên tố Cacbon & hợp chất; Ở bài này , chúng ta sẽ cùng tìm hiểu về nguyên tố Silic & hợp chất của Silic
3.2.Hình thành kiến thức mới :
|
Hoạt động của GV và HS |
Nội dung |
|
GV: Chiếu hình ảnh cho HS quan sát, sau đó rút ra nhận xét. HS: Trả lời. GV: Cho HS tham khảo SGK, nêu tính chất vật lí của Si? GV: Yêu cầu HS dựa vào bảng tuần hoàn hãy xác định vị trí của Si trong BTH. + Bước 1: Chuyển giao nhiệm vụ học tập: GV: Yêu cầu HS nêu số oxi hóa có thể có của Si từ đó dự đoán tính chất hóa học cơ bản của Si? Viết PTHH và xác định số oxi hóa của Si trong các phản ứng trên. + Bước 2: Học sinh thực hiện nhiệm vụ học tập: Cá nhân. + Bước 3: Báo cáo kết quả học tập: HS độc lập tư duy – Trình bày kết quả trước lớp qua nháp cá nhân. HS còn lại nghe, đánh giá, bổ sung (nếu có). + Bước 4: Đánh giá kết quả thực hiện GV chuẩn xác kiến thức GV: bổ sung thêm Silic còn có trong cơ thể động, thực vật với lượng nhỏ. GV: Viết phản ứng điều chế Si khi đun Al, C, Mg để khử SiO2? Từ đó suy ra cách điều chế ? GV: Viết CTCT của SiO2 và nêu các tính chất cơ bản của nó? được ứng dụng để làm gì? GV: Cho HS xem video thí nghiệm HF ăn mòn thủy tinh.(nếu có) GV: Bổ sung thêm phần kiến thức cách khắc chữ lên thủy tinh. GV: Viết CTCT của axit silixic? Nêu các tính chất cơ bản và ứng dụng của axit này? GV: Viết và gọi tên một vài muối silicat? HS: Nêu một số ứng dụng của muối silicat. GV: Chiếu hình ảnh về thủy tinh lỏng và ứng dụng của thủy tinh lỏng cho HS quan sát. |
A. SILIC: I. Tính chất vật lí: SGK- 76. II. Tính chất hóa học: 1. Tính khử: a. Tác dụng với phi kim: - F2 ở đk thường. - Cl2, Br2, I2, O2 khi đun nóng. - C, N, S ở t0 rất cao Vd : Si + 2F2 → SiF4.(silic tetraflorua) Si + O2 b. Tác dụng với hợp chất : Si + 2NaOH + H2O → Na2SiO3 + 2H2. 2. Tính oxi hóa: Tác dụng với Mg, Ca, Fe ở t0 cao. Vd : Si + 2Ca III. Trạng thái tự nhiên: SGK - 77 IV. Ứng dụng: SGK - 77 V. Điều chế: 1. Trong phòng thí nghiệm: SiO2 + 2Mg 2. Trong công nghiệp: SiO2 + 2C B. HỢP CHẤT CỦA SILIC I. Silic đioxit:(SiO2) - Tan dễ trong kiềm nóng chảy: SiO2 + 2NaOH nc - Tan được trong dd HF: SiO2 + 4HF → SiF4 + 2H2O. → dùng để khắc chữ và hình lên thủy tinh. II. Axit Silixic: (H2SiO3) - Tồn tại dạng keo, không tan trong H2O. - Khi sấy khô, axit silixic mất nước, tạo thành vật liệu xốp là silicagen. - Là một axit rất yếu (yếu hơn H2CO3) Na2SiO3 + H2O + CO2 → H2SiO3 + Na2CO3 III. Muối silicat: - Axit Silixic dễ tan trong dd kiềm, tạo thành muối silicat. - dd đậm đặc của Na2SiO3, K2SiO3 gọi là thủy tinh lỏng. |
3.3.Luyện tập :
a)Hoàn thành dãy chuyển hoá sau:
b)Viết các phương trình phân tử ứng với phương trình ion rút gọn sau đây : 2H+ + SiO32-à H2SiO3 ↓
4. Củng cố bài giảng : Nội dung trọng tâm của bài học :
- Silic là phi kim hoạt động hóa học yếu, ở nhiệt độ cao tác dụng với nhiều chất (oxi, cacbon, dung dịch NaOH, magie).
- Tính chất hóa học của hợp chất SiO2 (tác dụng với kiềm đặc, nóng, với dung dịch HF) ; hợp chất H2SiO 3 (là axit yếu, ít tan trong nước, tan trong kiềm nóng).
5. Bài tập về nhà:
- Học bài, làm bài tập 2,4,5,6/79SGK
- Đọc thêm bài “Công nghiệp Silicat”
- Chuẩn bị bài “Luyện tập”