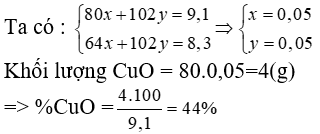Tiết 27 - Bài 19 : LUYỆN TẬP : TÍNH CHẤT HÓA HỌC
CỦA CACBON, SILIC VÀ HỢP CHẤT CỦA CHÚNG
I. MỤC TIÊU BÀI HỌC
1. Kiến thức:Hệ thống hóa , củng cố , khắc sâu kiển thức về :
- Sự giống nhau & khác nhau về cấu hình electron nguyên tử, tính chất cơ bản của cacbon & silic
- Sự giống nhau & khác nhau về thành phần phân tử , cấu tạo phân tử , tính chất cơ bản giữa các hợp chất : CO2 & SiO2 ; H2CO3 & H2SiO3 ; muối cacbonat & muối silicat
2. Kĩ năng :
- So sánh cấu hình electron nguyên tử, tính chất cơ bản của cacbon , silic & giữa các loại hợp chất tương ứng , rút ra những điểm giống nhau & khác nhau
- Viết các PTHH minh họa cho những kết luận về sự giống nhau & khác nhau giữa các đơn chất & giữa các hợp chất
- Giải các bài tập : phân biệt các chất đã biết , tính % khối lượng của các chất trong hỗn hợp phản ứng và một số bài tập tổng hợp có nội dung liên quan
3.Thái độ : Có thái độ học tập tích cực , chủ động
4. Năng lực cần hướng tới :
- Năng lực chung : tự học ; giao tiếp ;hợp tác ; tư duy logic, so sánh và tổng hợp ; vận dụng kiến thức hóa học vào thực tiễn
- Năng lực riêng : tư duy hóa học ;sử dụng ngôn ngữ hóa học ;tính toán hóa học
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Giáo Viên: Hệ thống câu hỏi và bài tập.
2. Học sinh: HS lập bảng để thảo luận.
III. TIẾN TRÌNH BÀI GIẢNG
1, Ổn định tổ chức : Kiểm tra sĩ số, đồng phục...
|
Lớp dạy |
|
|
Ngày dạy |
|
|
Sĩ số |
2. Kiểm tra bài cũ: Trong quá trình giảng dạy.
3. Bài mới:
3.1.Khởi động :
3.2.Hình thành kiến thức mới :
|
Hoạt động của GV và HS |
Nội dung |
||||||||||||||||||||||||||||||||||||
|
+ Bước 1: Chuyển giao nhiệm vụ học tập: GV chia học sinh thành 4 nhóm hoàn thành 4 phiếu trắc nghiệm + Bước 2: Học sinh thực hiện nhiệm vụ học tập: hđ nhóm. + Bước 3: Báo cáo kết quả học tập: HS độc lập tư duy – Trình bày kết quả trước lớp . HS còn lại nghe, đánh giá, bổ sung (nếu có). + Bước 4: Đánh giá kết quả thực hiện GV chuẩn xác kiến thức |
I. KIẾN THỨC CẦN NHỚ: 1. Lập bảng so sánh về các tính chất của C và Si theo phiếu học tập. 2. Lập bảng so sánh các chất CO2, SiO2, và CO2 theo phiếu học tập. 3. Lập bảng so sánh về các tính chất của H2CO3, H2SiO3 theo phiếu học tập. 4. So sánh tính chất của muối cacbonat và silicat theo phiếu học tập. |
||||||||||||||||||||||||||||||||||||
|
Phiếu học tập 1:
|
|||||||||||||||||||||||||||||||||||||
|
Phiếu học tập 2:
|
|||||||||||||||||||||||||||||||||||||
|
Phiếu học tập 3:
|
|||||||||||||||||||||||||||||||||||||
|
Phiếu học tập 4:
|
|||||||||||||||||||||||||||||||||||||
|
Câu 1: Cacbon và silic đều giống nhau về: A. Tính khử mạnh. B. Tính oxi hóa mạnh. C. P/ư với O2 và H2. D. Có tính oxh và khử. |
II. BÀI TẬP: 1.Trắc nghiệm khách quan Câu 1 : Đáp án D. |
||||||||||||||||||||||||||||||||||||
|
Câu 2 : CO2 và SiO2 đều tác dụng được với tất cả các chất trong dãy: A. H2O, dd NaOH.B. NaOH, KOH nchảy. C. HF, nước vôi trong.D.HCl,Ca(OH)2 nóng chảy. |
Câu 2 : Đáp án B. |
||||||||||||||||||||||||||||||||||||
|
Câu 3 : Cho 5,94 (g) hh K2CO3 và Na2CO3 tác dụng hết với dd H2SO4. Sau phản ứng ta được 7,74 gam hh 2 muối sunfat . Khối lượng K2CO3 và Na2CO3 ban đầu lần lượt là ? (g): A. 2,76 và 3,18.B. 3,45 và 2,49. C. 3,20 và 2,74D. 2,07 và 3,87. |
Câu 3 : Đáp án |
||||||||||||||||||||||||||||||||||||
|
BT1: Viết PTHH hoàn thành dãy chuyển hoá sau: Si -> SiO2 -> Na2SiO3 -> H2SiO3 -> SiO2 -> Si |
2. Bài tập tự luận : BT1: 1) Si + O2 2) SiO2 + 2NaOH → Na2SiO3 + H2O 3) Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3 4) H2SiO3 5) SiO2 + 2Mg |
||||||||||||||||||||||||||||||||||||
|
BT2: Bằng phương pháp hoá học, hãy nhận biết các dung dịch đựng trong các lọ mất nhãn sau: HCl, NaOH, Na2CO3, NaNO3, Na3PO4? |
BT2: - Quì tím: Nhận biết HCl, NaOH - Axit HCl: Nhận biết Na2CO3 - Dung dịch AgNO3: Nhận biết Na3PO4 |
||||||||||||||||||||||||||||||||||||
|
BT3: Khử 16 gam hỗn hợp các oxit kim loại: FeO, Fe2O3, Fe3O4, CuO và PbO bằng khí CO ở nhiệt độ cao, khối lượng chất rắn thu được là 11,2 gam. Tính thể tích khí CO đã tham gia phản ứng ở điều kiện chuẩn? |
BT3: Gọi x là số mol CO tham gia phản ứng => Số mol CO2 = x mol Áp dụng định luật bảo toàn khối lượng ta có : 16 + 28x = 11,2 + 44x => x = 0,3 Thể tích CO đã tham gia phản ứng : V = 0,3.22,4= 6,72 lit; %Al2O3 = 56% |
||||||||||||||||||||||||||||||||||||
|
BT4: Cho luồng khí CO dư đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Tính % khối lượng mỗi oxit trong hỗn hợp đầu? |
BT4 : Chỉ có CuO bị CO khử nên hỗn hợp chất rắn thu được gồm Cu và Al2O3
|
||||||||||||||||||||||||||||||||||||
|
BT5: Cho 6,72 lít CO2 (đktc) vào 100 ml dd NaOH 3M. Sau phản ứng ta thu được muối gì, khối lượng bao nhiêu gam? |
BT5 :nCO2 → 0,3 mol nNaOH → 0,3 mol - PTPƯ: CO2 + NaOH → NaHCO3. - Thu được muối NaHCO3 với khối lượng là : 25,2 gam. |
||||||||||||||||||||||||||||||||||||
4. Củng cố
- GV hệ thống lại bài học
5.Hướng dẫn về nhà :
- Ôn tập chương 3 : Cacbon – Silic
- Chuẩn bị bài sau : Mở đầu về hóa học hữu cơ

 SiO2
SiO2