TIẾT 12: AMONIAC VÀ MUỐI AMONI (T1)
I/ Mục tiêu
1/ Kiến thức:
- HS biết: Cấu tạo phân tử, tính chất vật lí (tính tan, tỉ khối, màu, mùi), ứng dụng chính, cách điều chế amoniac trong phòng thí nghiệm và trong công nghiệp .
- Hiểu: Tính chất hoá học của amoniac: Tính bazơ yếu (tác dụng với nước, dung dịch muối, axit) và tính khử (tác dụng với oxi, clo)
2/ Kỹ năng
- Dự đoán tính chất hóa học, kiểm tra bằng thí nghiệm và kết luận được tính chất hoá học của amoniac.
- Quan sát thí nghiệm hoặc hình ảnh..., rút ra được nhận xét về tính chất vật lí và hóa học của amoniac.
- Viết được các PTHH dạng phân tử hoặc ion rút gọn.
- Phân biệt được amoniac với một số khí đã biết bằng phương pháp hoá học.
- Tính thể tích khí amoniac sản xuất được ở đktc theo hiệu suất.phản ứng
3. Thái độ: Biết nguyên nhân gây ô nhiễm môi trường của việc sản xuất NH3 , có ý thức bảo vệ môi trường sống
4. Năng lực cần hướng tới :
- Năng lực chung : tự học ; giao tiếp ;hợp tác ; tư duy logic, so sánh và tổng hợp ; vận dụng kiến thức hóa học vào thực tiễn
- Năng lực riêng : tư duy hóa học ;sử dụng ngôn ngữ hóa học ;tính toán hóa học ; thực hành hóa học
II/ Chuẩn bị
1, Giáo viên : Giáo án ; TNCM : Điều chế & Thử tínhchất của NH3 : tính tan trong nước ; tính bazơ yếu : tác dụng với quỳ ẩm , dd AlCl3 , dd HCl đặc , dd H2SO4
- DC : Chậu thủy tinh đựng nước, lọ đựng khí NH3 với nút cao su có ống thủy tinh vuốt nhọn xuyên qua ; ống nghiệm ; kẹp gỗ; đèn cồn ; giá thí nghiệm ;
- HC: Giấy quỳ tím; dd AlCl3; dd NH3 ; khí NH3 ; dd HCl đặc; dd H2SO4 ; NH4Cl ; Ca(OH)2
2, Học sinh : Ôn lại cách viết cấu hình e nguyên tử, đặc điểm liên kết hóa học; đọc trước bài
III. TIẾN TRÌNH BÀI GIẢNG
1, Ổn định tổ chức : Kiểm tra sĩ số, đồng phục...
|
Lớp dạy |
|
|
Ngày dạy |
|
|
Sĩ số |
2, Kiểm tra bài cũ : Đặc điểm liên kết trong phân tử N2? SOH có thể có của N trong hợp chất từ đó trình bày tính chất hóa học của N2 và viết phương trình phản ứng minh họa
3. Bài mới:
3.1- Khởi động : Nguyên tố N có nhiều mức oxi hóa , trong hợp chất NH3 là -3 ; NH3 là chất gì ? Tính chất ra sao ? Chúng ta cùng tìm hiểu qua bài mới
3.2- Hình thành kiến thức mới :
Hoạt động 1: Cấu tạo phân tử và tính chất vật lý của Amoniac
+ Bước 1: Chuyển giao nhiệm vụ học tập:
Viết cấu hình e của N và H, viết công thức e, CTPT của NH3
Từ độ âm điện của nguyên tử N và H, nhận xét về đặc điểm liên kết N-H trong phân tử NH3+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Nhóm thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS trình bày kết quả.
Nhóm khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
A/ AMONIAC
I/ Cấu tạo phân tử và tính chất vật lý của Amoniac
1. Cấu tạo phân tử
- CTPT NH3
- Công thức e: 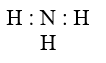
- CTCT: 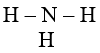
Nhận xét:
- Nguyên tử N liên kết với 3 nguyên tử H bằng 3 liên kết cộng hoá trị phân cực về N, nguyên tử N còn 1 cặp e chưa liên kết có thể tham gia liên kết với các nguyên tử khác
- Phân tử NH3 là phân tử phân cực.
- Nguyên tử N có số oxi hoá là -3, thấp nhất trong số các trạng thái oxi hoá của N
2. Tính chất vật lý
- Điều kiện thường: Khí, không màu, mùi khai xốc
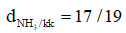 => nhẹ hơn không khí
=> nhẹ hơn không khí
- Tan nhiều trong nước
- Dd NH3 đặc trong PTN có nồng độ 25%
Hoạt động 2: Tính chất hóa học
+ Bước 1: Chuyển giao nhiệm vụ học tập:
Từ SOH của N và công thức e của NH3 hãy suy đoán tính chất hóa học. Viết ptpu của NH3 và H2SO4
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Nhóm thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS trình bày kết quả.
Nhóm khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
II/ Tính chất hóa học
1/ Tính bazơ yếu
a/ Tác dụng với nước
NH3 + H2O ⇄ NH4+ + OH-
- Dung dịch tồn tại NH3, NH4+, OH- do phản ứng thuận nghịch, không tồn tại NH4OH
- Dung dịch có tính bazơ yếu và dẫn điện
- Nhận biết khí NH3: Quì tím ẩm
b/ Tác dụng với dung dịch muối
FeCl3 + 3NH3 +3H2O → 3NH4Cl + Fe(OH)3 ↓
Fe3+ + 3NH3+ 3H2O → 3NH4+ + Fe(OH)3 ↓
AlCl3 + 3NH3 +3H2O → 3NH4Cl + Al(OH)3 ↓
Al3+ + 3NH3+ 3H2O → 3NH4+ + Al(OH)3 ↓
c/ Tác dụng axit
NH3 + HCl → NH4Cl
NH3 + H2SO4 → (NH4)2SO4
NH3 + H+ → NH4+
NX: Sản phẩm của phản ứng giữa axit và NH3 là muối amoni
2/ Tính khử
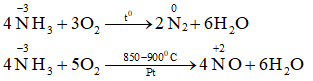
NX: Trong phản ứng với chất oxi hóa như O2 → SOH của N tăng thể hiện tính khử
Hoạt động 3: Ứng dụng và điều chế
+ Bước 1: Chuyển giao nhiệm vụ học tập:
HS nghiên cứu sgk
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Nhóm thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS trình bày kết quả.
Nhóm khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
III. Ứng dụng và điều chế
- Là nguồn nguyên liệu sản xuất phân đạm
- Sản xuất HNO3, hiđrazin...
1/ Trong PTN
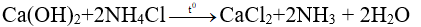
- Điều chế lượng nhỏ → đung nóng dd NH3
2/ Trong công nghiệp
- Nguyên liệu: N2 và H2
- Biện pháp kĩ thuật:
+ Nhiệt độ: 450 - 5000C
+ Áp suất: 200 - 3000C
+ Xúc tác: Fe + Al2O3, K2O,...
3.3, Hoạt động luyện tập
+ Bước 1: Chuyển giao nhiệm vụ học tập:
Tại sao khi đi gần các sông , hồ bẩn vào ngày nắng nóng , người ta lại thấy mùi khai ?
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Nhóm thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS trình bày kết quả.
Nhóm khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
-Khi nước sông , hồ bị ô nhiễm nặng bởi các chất hữu cơ giàu đạm như : nước tiểu , phân hữu cơ, rác thải hữu cơ , ... lượng urê trong các chất hữu cơ sinh ra nhiều. Dưới tác dụng của men ureaza của các vi sinh vật , urê bị phân hủy tiếp thành CO2 và NH3 theo pư sau : (NH2)2CO +H2O → CO2 + 2NH3
- NH3 sinh ra hòa tan trong nước sông hồ theo một cân bằng động như sau :
NH3 + H2O ⇄ NH4+ + OH- (pH>7, nhiệt độ thấp)
- Khi trời năng (nhiệt độ cao) thì lại có pư sau :
NH4+ + H2O → NH3 +H3O+(pH<7)
4, Củng cố :
- Cấu tạo phân tửamoniac
- Amoniac là một bazơ yếu có đầy đủ tính chất của một bazơ ngoài ra còn có tính khử.
- Phân biệt được amoniac với một số khí khác bằng phương pháp hoá học.
5, Hướng dẫn về nhà :
- Bài tập 1, 5 (SGK)
- BTVN: 7, 8 (SGK); đọc trước phần B - Muối amoni
BÀI 12 - TIẾT 13: AMONIAC VÀ MUỐI AMONI (T2)
I/ Mục tiêu
1/ Kiến thức:HS biết:
- Tính chất vật lí (trạng thái, màu sắc, tính tan).
- Tính chất hoá học (phản ứng với dung dịch kiềm, phản ứng nhiệt phân) và ứng dụng
2/ Kĩ năng
- Quan sát thí nghiệm, rút ra được nhận xét về tính chất của muối amoni.
- Viết được các PTHH dạng phân tử, ion thu gọn minh hoạ cho tính chất hoá học.
- Phân biệt được muối amoni với một số muối khác bằng phương pháp hóa học. Tính % về khối lượng của muối amoni trong hỗn hợp.
3. Thái độ : Biết nguyên nhân gây ô nhiễm môi trường của việc sản xuất NH3 , có ý thức bảo vệ môi trường sống
4. Năng lực cần hướng tới :
- Năng lực chung : tự học ; giao tiếp ;hợp tác ; tư duy logic, so sánh và tổng hợp ; vận dụng kiến thức hóa học vào thực tiễn
- Năng lực riêng : tư duy hóa học ;sử dụng ngôn ngữ hóa học ;tính toán hóa học ; thực hành hóa học
II/ Chuẩn bị
- GV: SGK, giáo án, SGV, STK; Các thí nghiệm: Muối amoni tác dụng dd kiềm, nhiệt phân muối amoni
+) Dụng cụ: ống nghiệm, ống nhỏ giọt, giá ống nghiệm, đèn cồn, thìa thủy tinh
+) Hóa chất: Muối amoni, NaOH, NH4Cl
- HS: Ôn lại bài cũ, xem trước phần muối amoni
III/ Tiến trình lên lớp
1, Ổn định tổ chức : Kiểm tra sĩ số, đồng phục...
|
Lớp dạy |
|
|
Ngày dạy |
|
|
Sĩ số |
2, Kiểm tra bài cũ :
- Câu hỏi: 1. Trình bày tính chất hóa học của NH3? Viết phương trình minh họa?
2. Trình bày đặc điểm cấu tạo phân tử NH3? Phương pháp điều chế trong PTN và trong công nghiệp
3. Bài mới:
3.1- Khởi động : Hãy viết CTPT của muối amoni ? Muối amoni có tính chất vật lí & hóa học nào ? Chúng ta cùng tìm hiểu qua bài học hôm nay
3.2- Hình thành kiến thức mới :
Hoạt động 1: Tính chất vật lý và tính chất hóa học của muối amoni
+ Bước 1: Chuyển giao nhiệm vụ học tập:
Muối amoni có gì giống và khác với các muối đã học? Dự đoán tính chất hóa học? Viết phản ứng nhiệt phân NH4NO3 , NH4NO2
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Nhóm thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS trình bày kết quả.
Nhóm khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
B/ Muối amoni
- Muối amoni là tinh thể ion, gồm cation amoni và anion gốc axit: NH4Cl, NH4NO3...
I/ Tính chất vật lý
- Trạng thái rắn
- Tất cả muối amoni đều tan nhiều trong nước, điện li hoàn toàn thành ion, ion NH4+ không màu
II/ Tính chất hóa học
1/ Tác dụng với dung dịch kiềm
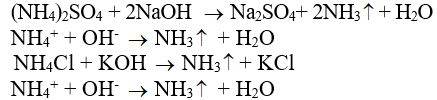
NX: Muối amoni tác dụng với dd kiềm sinh ra NH3
Chú ý: Phản ứng giữa muối amoni và dd kiềm được dùng để điều chế NH3 trong PTN và nhận biết muối amoni
2/ Phản ứng nhiệt phân
+) Muối amoni tạo bởi axit không có tính oxi hóa mạnh ở gốc
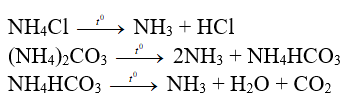
- Phản ứng nhanh hơn khi đun nóng
Nhận xét:
- Muối amoni dễ phân hủy bởi nhiệt
- Nhiệt phân muối amoni chứa gốc axit không có tính oxi hóa mạnh tạo NH3 và axit
+) Muối amoni tạo bởi axit có tính oxi hóa mạnh ở gốc
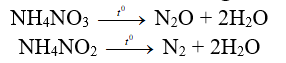
*) Ứng dụng
- NH4HCO3 dùng làm bột nở trong chế biến thực phẩm
- NH4NO2: Điều chế N2 trong PTN
- NH4NO3: Điều chế N2O trong PTN
3.3, Hoạt động luyện tập :
+ Bước 1: Chuyển giao nhiệm vụ học tập:
Bài 1. Hoàn thành các phương trình hoá học sau đây :
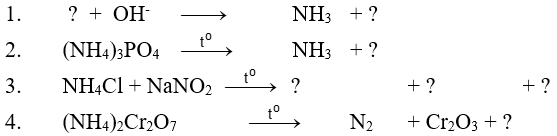
Bài 2 : Chỉ được dùng một kim loại, hãy trình bày cách phân biệt các dung dịch muối sau đây : NH4NO3, (NH4)2SO4, K2SO4. Viết phương trình hoá học của các phản ứng xảy ra
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Nhóm thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS trình bày kết quả.
Nhóm khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
Bài 1. Hoàn thành các phương trình hoá học
Hướng dẫn giải :Các phương trình hoá học :
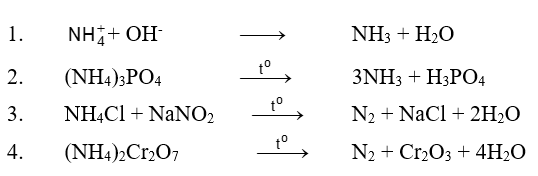
Bài 2 : Chỉ được dùng một kim loại, hãy trình bày cách phân biệt các dung dịch muối sau đây : NH4NO3, (NH4)2SO4, K2SO4. Viết phương trình hoá học của các phản ứng xảy ra
Hướng dẫn giải :
Dùng kim loại bari để phân biệt các dung dịch muối : NH4NO3, (NH4)2SO4, K2SO4.
Lấy mỗi dung dịch một ít (khoảng 2-3 ml) vào từng ống nghiệm riêng. Thêm vào mỗi ống một mẩu nhỏ kim loại bari. Đầu tiên kim loại bari phản ứng với nước tạo thành Ba(OH)2, rồi Ba(OH)2 phản ứng với dung dịch muối.
- Ở ống nghiệm nào có khí mùi khai (NH3) thoát ra, ống nghiệm đó đựng dung dịch NH4NO3 :
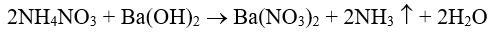
- Ở ống nghiệm nào có kết tủa trắng (BaSO4) xuất hiện, ống nghiệm đó đựng dung dịch K2SO4 :
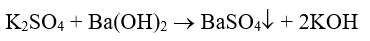
- Ở ống nghiệm nào vừa có khí mùi khai (NH3) thoát ra, vừa có kết tủa trắng (BaSO4) xuất hiện, ống nghiệm đó đựng dung dịch (NH4)2SO4 :
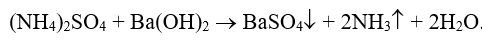
4/ Củng cố : Nội dung trọng tâm của bài :
- Cấu tạo phân tửamoniac
- Amoniac là một bazơ yếu có đầy đủ tính chất của một bazơ ngoài ra còn có tính khử.
- Muối amoni có phản ứng với dung dịch kiềm, phản ứng nhiệt phân.
- Phân biệt được amoniac với một số khí khác, muối amoni với một số muối khác bằng phương pháp hoá học.
5, Hướng dẫn về nhà: Hoàn thành bài tập SGK, SBT và nghiên cứu trước bài axit nitric và muối nitrat

