CHƯƠNG 2 :NITƠ - PHOTPHO
Tiết 11. Bài 7 : NITƠ
I. MỤC TIÊU BÀI HỌC
1, Kiến thức :
* Biết được:
- Vị trí trong bảng tuần hoàn , cấu hình electron nguyên tử của nguyên tố nitơ.
- Cấu tạo phân tử, tính chất vật lí (trạng thái, màu, mùi, tỉ khối, tính tan), ứng dụng chính, trạng thái tự nhiên; điều chế nitơ trong phòng thí nghiệmvà trong công nghiệp
* Hiểu được:
- Phân tử nitơ rất bền do có liên kết ba, nên nitơ khá trơ ở nhiệt độ thường, nhưng hoạt động hơn ở nhiệt độ cao.
- Tính chất hoá học đặc trưng của nitơ: tính oxi hoá (tác dụng với kim loại mạnh, với hiđro), ngoài ra nitơ còn có tính khử (tác dụng với oxi).
2, Kĩ năng :
- Dự đoán tính chất, kiểm tra dự đoán và kết luận về tính chất hoá học của nitơ.
- Viết các PTHH minh hoạ tính chất hoá học.
- Tính thể tích khí nitơ ở đktc trong phản ứng hoá học; tính % thể tích nitơ trong hỗn hợp khí.
3. Thái độ : Vận dụng kiến thức về nitơ, giải thích các hiện tượng trong tự nhiên
4. Năng lực cần hướng tới :
- Năng lực chung : tự học ; giao tiếp ;hợp tác ; tư duy logic, so sánh và tổng hợp ; vận dụng kiến thức hóa học vào thực tiễn
- Năng lực riêng : tư duy hóa học ;sử dụng ngôn ngữ hóa học ;tính toán hóa học ; thực hành hóa học
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Giáo viên:
- Bảng TH các nguyên tố hóa học.
- Hệ thống câu hỏi để học sinh hoạt động.
2. Học sinh: Đọc trước bài mới
III. TIẾN TRÌNH BÀI GIẢNG
1, Ổn định tổ chức : Kiểm tra sĩ số, đồng phục...
|
Lớp dạy |
|
|
Ngày dạy |
|
|
Sĩ số |
2, Kiểm tra bài cũ : Kết hợp trong bài
3. Bài mới:
3.1- Khởi động : Trong không khí luôn có một hàm lượng khí Ni tơ rất lớn( 80%) thể tích không khí, tuy nhiên ta không nhận biết được nitơ bằng giác quan, đồng thời cũng không gặp p/ư hóa học của Ni tơ ở điều kiện thường. Vậy nitơ có đặc điểm cấu tạo và tính chất ntn chúng ta cùng nhau nghiên cứu.
3.2- Hình thành kiến thức mới :
Hoạt động 1: Vị trí, cấu hình electron nguyên tử và tính chất vật lý của nitơ
+ Bước 1: Chuyển giao nhiệm vụ học tập:
Dựa vào HTTH, xác định vị trí của nitơ, viết cấu hình electron và CTCT của N2? Nêu các tính chất vật lí của N2
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Nhóm thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS trình bày kết quả.
Nhóm khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
I. Vị trí và cấu hình electron nguyên tử và tính chất vật lý của nitơ
* Ô số 7, nhóm VA, chu kì 2.
* Cấu hình electron : 1s22s22p3.
→> Tạo được 3 liên kết cộng hóa trị với các nguyên tử khác.
* Cấu tạo phân tử N2 :N ≡ N.
Ở điều kiện thường N2 :
- Chất khí, không màu, không mùi, không vị, hơi nhẹ hơn không khí.
- Hóa lỏng ở -1960C, hóa rắn ở -2100C
- Rất ít tan trong nước.
- Không duy trì sự sống và sự cháy.
Hoạt động 2: Tính chất hóa học
+ Bước 1: Chuyển giao nhiệm vụ học tập:
Từ đặc điểm cấu tạo hãy nêu tính chất hóa học cơ bản của nitơ?
Viết phản ứng xảy ra giữa N2 và Mg và với H2, xác định vai trò của các chất phản ứng?
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Nhóm thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS trình bày kết quả.
Nhóm khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
II. Tính chất hóa học:
* Ở t0 thường, N2 rất bền (trơ).
* Ở t0 cao, N2 là nguyên tố hoạt động.
* Với các nguyên tố có độ âm điện bé hơn như hidro, kim loại...nitơ tạo hợp chất với số oxi hóa -3. Trong hợp chất với các nguyên tố có ĐAĐ lớn hơn như oxi, flo, nitơ có các số oxi hóa dương.
1. Tính oxi hóa:
a. Với kim loại:
* t0 cao : N2 tác dụng được với một số kim loại như Ca, Mg, Al...
VD: N2 + 3Mg --t0→ Mg3N2.
b. Với hidro:(t0 cao, P cao, có xúc tác)
3H2 + N2<---→2NH3.
* Số oxi hóa của nitơ giảm từ 0 xuống -3, thể hiện tính oxi hóa.
2. Tính khử:
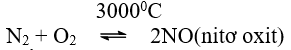
* Số oxi hóa của Nitơ tăng từ 0 đến +2, thể hiện tính khử.
* NO không màu phản ứng ngay với oxi không khí tạo NO2 có màu nâu đỏ.
2NO + O2 → 2NO2. (nitơ dioxit)
* Ngoài ra nitơ còn tạo được một số oxit khác (không điều chế trực tiếp) như N2O, N2O3, N2O5.
|
N2O |
NO |
N2O3 |
NO2 |
N2O5 |
|
Khí không màu |
Khí không màu |
Lỏng xanh thẫm |
Khí nâu đỏ |
Rắn |
Hoạt động 3: Ứng dụng, trạng thái tự nhiên
+ Bước 1: Chuyển giao nhiệm vụ học tập:
Cho biết ứng dụng và trạng thái tự nhiên của nitơ?
Nêu phương pháp điều chế N2 trong công nghiệp?
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Nhóm thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS trình bày kết quả.
Nhóm khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
III. Ứng dụng, trạng thái tự nhiên:
1. Ứng dụng:
- Là thành phần dinh dưỡng chính của thực vật.
- Là nguyên liệu tổng hợp NH3, HNO3, phân đạm...
- Tạo môi trường trơ cho các nghành công nghiệp : luyện kim, thực phẩm, điện tử...
- Nitơ lỏng dùng để bảo quản máu và các mẫu vật sinh học khác.
2. Trạng thái tự nhiên:
- Ở dạng tự do : chiếm 78,16% thể tích không khí (4/5) gồm 2 đồng vị là 714N (99,63%) và 715N (0,37%).
- ở dạng hợp chất : khoáng NaNO3 (diêm tiêu natri).
3. Điều chế trong công nghiệp:
PP : Chưng cất phân đoạn không khí lỏng.
3.3. Hoạt động luyện tập
+ Bước 1: Chuyển giao nhiệm vụ học tập: Cho hỗn hợp các chất khí sau : N2, CO2, SO2, Cl2, HCl. Làm thế nào để thu được nitơ tinh khiết từ hỗn hợp khí trên. Giải thích cách làm và viết các phương trình hoá học (nếu có).
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Nhóm thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS trình bày kết quả.
Nhóm khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
Trả lời : Cho hỗn hợp các chất khí đi từ từ qua dung dịch NaOH lấy dư. Các khí CO2, SO2, Cl2, HCl phản ứng với NaOH, tạo thành các muối tan trong dung dịch. Khí nitơ không phản ứng với NaOH sẽ thoát ra ngoài. Cho khí nitơ có lẫn một ít hơi nước đi qua dung dịch H2SO4 đậm đặc, hơi nước sẽ bị H2SO4 hấp thụ, ta thu được khí nitơ tinh khiết.
Các phương trình hoá học :
CO2 + 2NaOH → Na2CO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
HCl + NaOH → NaCl + H2O
3.4, Hoạt động vận dụng :
+ Bước 1: Chuyển giao nhiệm vụ học tập:
Làm thế nào để chứng minh được N chiếm 4/5 thể tích của không khí ?
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Nhóm thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS trình bày kết quả.
Nhóm khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
- Đốt cháy P trong ống thủy tinh úp trong chậu thủy tinh có chứanước , P cháy sẽ tác dụng hết với khí oxi trong bình, theo pư sau : 4P+ 5O2 → 2P2O5
- Sau đó , P2O5 sẽ tan hết trong nước, mực nước trong ống dâng lên chiếm khoảng 1/5 , như vậy khí còn lại trong ống thủy tinh chủ yếu là nitơ chiếm khoảng 4/5
3.5, Hoạt động tìm tòi mở rộng
+ Bước 1: Chuyển giao nhiệm vụ học tập:
Nguyên tố N pư với nhiều kim loại , nhưng tại sao trong vỏ trái đất không gặp nitrua kim loại nào ?
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Nhóm thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS trình bày kết quả.
Nhóm khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức, kiểm tra sp ở nhà của HS
- N2 pư được với nhiều kim loại (Li ở nhiệt độ thường ; Ca & Mg , … khi đun nóng ) . Khi hình thành trái đất , thời kì đầu rất nóng là điều kiện cho N2 có thể tác dụng với nhiều kim loại tạo nitrua ; Nhưng ở nhiệt độ này, H2 & O2 cũng đã hóa hợp với nhau tạo ra nước , khi có mặt nước , các nitrua kim loại bị thủy phân
Ca3P2 + 6H2O → 2NH3 + 3Ca(OH)2
- Ở nhiệt độ cao , NH3 tạo ra có thể cháy :
4NH3 + 3O2 → 2N2 + 6H2O
- Vì vậy, trong vỏ trái đất không gặp một nitrua kim loại nào

