Tiết 06 - Bài 3 : SỰ ĐIỆN LI CỦA NƯỚC. pH. CHẤT CHỈ THỊ AXIT-BAZƠ
I. MỤC TIÊU BÀI HỌC
1, Kiến thức: Biết được:
- Tích số ion của nước, ý nghĩa tích số ion của nước.
- Khái niệm về pH, định nghĩa môi trường axit, môi trường trung tính và môi trường kiềm.
- Chất chỉ thị axit - bazơ : quỳ tím, phenolphtalein và giấy chỉ thị vạn năng
2, Kĩ năng
- Tính pH của dung dịch axit mạnh, bazơ mạnh.
- Xác định được môi trường của dung dịch bằng cách sử dụng giấy chỉ thị vạn năng, giấy quỳ tím hoặc dung dịch phenolphtalein.
3. Thái độ : Học sinh được học những kiến thức thiết thực & gần gũi với đời sống hàng ngày & sản xuất , do đó khuyến khích các em chăm học để giúp ích cho bản thân & xã hội
4. Năng lực cần hướng tới :
- Năng lực chung : tự học ; giao tiếp ; hợp tác ; tư duy logic, so sánh và tổng hợp ; vận dụng kiến thức hóa học vào thực tiễn
- Năng lực riêng : tư duy hóa học ; sử dụng ngôn ngữ hóa học ; tính toán hóa học ; thực hành hóa học
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Giáo viên: Giáo án ; TNCM : Thử pH của một số dung dịch
2. Học sinh: Soạn bài : Bài 3- Sự điện li của nước. pH. Chất chỉ thị axit-bazơ
III. TIẾN TRÌNH BÀI GIẢNG
1, Ổn định tổ chức : Kiểm tra sĩ số, đồng phục...
|
Lớp dạy |
|
|
Ngày dạy |
|
|
Sĩ số |
2, Kiểm tra bài cũ :
Phân loại các hợp chất sau và viết phương trình điện li: Na2SO4, NH4Cl, NaHSO3, H2SO3,
Bài giải :
* Phân loại :
- muối trung hòa : Na2SO4, NH4Cl
- muối axit : NaHSO3 ,
- axit : H2SO3
* Phương trình điện li :
(1) Na2SO4 → 2Na+ + SO32-
(2) NH4Cl → NH4+ + Cl‑
(3) Na2HPO4 → 2Na+ + HPO42-
(3`) HPO42- ⇄ H+ + PO43-
(4) H2SO3 ⇄ H+ + HSO3-
(4`) HSO32- ⇄ H+ + SO32-
3, Bài mới :
3.1- Khởi động : Liên hệ thí nghiệm bài sự điện li “Nước cất có dẫn điện không? Vì sao?”. Trên thực tế nước có điện li nhưng điện li rất yếu :
3.2- Hình thành kiến thức mới :
Hoạt động 1: Nước là chất điện li yếu
+ Bước 1: Chuyển giao nhiệm vụ học tập: GV: Thông báo bằng dụng cụ cực nhạy, người ta nhận thấy nước cũng dẫn điện cực yếu => nước cũng điện li rất yếu, yêu cầu HS viết phương trình điện li của nước.
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Cá nhân thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS xung phong trình bày kết quả.
HS khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
I/ Nước là chất điện li yếu:
1/ Sự điện li của nước:
Nước điện li rất yếu theo phương trình sau:
(1) 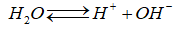
2/ Tích số ion của nước:
(1) → Trong nước tinh khiết (môi trường trung tính): [H+] → [OH-]
→ Vậy trong môi trường trung tính có:
[H+] → [OH-]
+ ở 250C, trong nước nguyên chất có:
[H+] → [OH-] → 1,0.10-17 M.
Đặt: 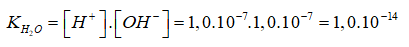
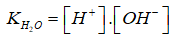 được gọi tích số ion của nước ở nhiệt độ xác định, tích số này là hằng số không những trong nước tinh khiết mà cả trong những dung dịch loãng khác nữa & nhiệt độ không khác nhiều với 250C
được gọi tích số ion của nước ở nhiệt độ xác định, tích số này là hằng số không những trong nước tinh khiết mà cả trong những dung dịch loãng khác nữa & nhiệt độ không khác nhiều với 250C
3/ Ý nghĩa tích số ion của nước:
a/ Môi trường axit:
Khi cho axit HCl vào nước:
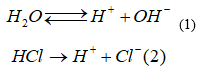
Nhờ (2) mà nồng độ H+ trong dung dịch tăng → cân bằng (1) chuyển dịch sang trái, làm cho nồng độ OH- do nước phân li ra trong dung dịch giảm. Do 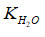 là hằng số, ta có:
là hằng số, ta có: 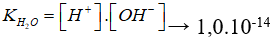
→ 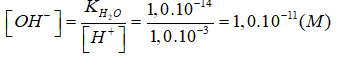
→ Ta có:
[H+] → 1,0.10-3M > [OH-] → 1,0.10-11M
→> Môi trường axit là môi trường có:
[H+] > [OH-] hay [H+] > 1,0.10-7M
b/ Môi trường kiềm:
Khi cho NaOH vào nước:
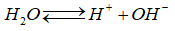 (1)
(1)
NaOH Na+ + OH- (3)
Nhờ (3) mà nồng độ OH- trong dung dịch tăng → cân bằng (1) chuyển dịch sang trái, làm cho nồng độ H+ do nước phân li ra trong dung dịch giảm. Do 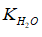 là hằng số, ta có:
là hằng số, ta có: 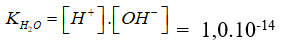
→ 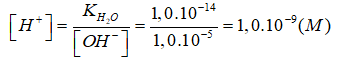
→ Ta có:
[H+] → 1,0.10-9M < [OH-] → 1,0.10-5M
→> Môi trường kiềm là môi trường có:
[H+] < [OH-] hay [H+] < 1,0.10-7M
* Kết luận:
+ Môi trường trung tính: [H+] > 1,0.10-7M
+ Môi trường axit: [H+] < 1,0.10-7M
+ Môi trường kiềm: [H+] → 1,0.10-7M
Hoạt động 2: Khái niệm pH, chất chỉ thị axit – bazơ
+ Bước 1: Chuyển giao nhiệm vụ học tập:
GV: Giới thiệu: để đánh giá độ kiềm, độ axit của dung dịch có thể dựa vào [H+], tuy nhiên để tránh ghi giá trị [H+] với số mũ âm, người ta dùng gía trị pH với quy ước: pH → - lg[H+] < → > [H+] → 10- pH.
Nếu [H+] → 10- a thì pH của dung dịch có giá trị bằng bao nhiêu?
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Cá nhân thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS xung phong trình bày kết quả.
HS khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
II/ Khái niệm pH, chất chỉ thị axit – bazơ:
1/ Khái niệm về pH:
- Để đánh giá độ kiềm, độ axit của dung dịch có thể dựa vào [H+].
- Để tránh ghi giá trị [H+] với số mũ âm, người ta dùng gía trị pH với quy ước:
pH → - lg[H+] < → > [H+] → 10- pH
→> Ta có:
+ pH → 7 => môi trường trung tính.
+ pH < 7 => môi trường axit.
+ pH > 7 => môi trường kiềm.
- Vì các dung dịch thường dùng có:
10-14 ≤ [H+] ≤ 10-1 nên thông thường ta có: 1 ≤ pH ≤ 14
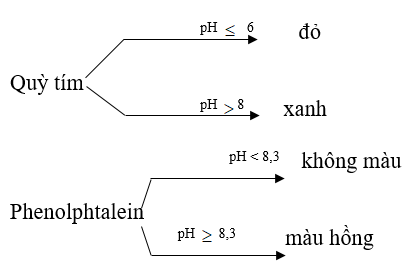
2/ Chất chỉ thị axit – bazơ:
* Đ/N: Chất chỉ thị axit – bazơ là chất có màu biến đổi phụ thuộc theo giá trị pH của dung dịch.
- Khi trộn lẫn một số chất chỉ thị axit – bazơ có màu biến đổi kế tiếp nhau theo giá trị pH ta thu được chất chỉ thị vạn năng.
- Màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau:
4. Củng cố
Nội dung trọng tâm :
- Đánh giá độ axit và độ kiềm của các dung dịch theo nồng độ ion H+ và pH
- Xác định được môi trường của dung dịch dựa vào màu của giấy chỉ thị vạn năng,giấy quỳ và dung dịch phenolphtalein
+ Bước 1: Chuyển giao nhiệm vụ học tập:
- Vì sao nước cất để lâu ngày trong không khí lại có pH <7 ?
- Tại sao phèn nhôm (CT : K2SO4 . Al2(SO4)3.24H2O) lại có vị chua ?
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Cá nhân thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS xung phong trình bày kết quả.
HS khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
|
- Vì sao nước cất để lâu ngày trong không khí lại có pH <7 ? |
- Vì nước cất để lâu ngày ngoài không khí sẽ hòa tan một lượng khí CO2 theo PT sau : CO2 + 2H2O ⇄ HCO3‑ + H3O+ HCO3‑ + 2H2O ⇄ CO32- + H3O+ Vì trong dd có ion H3O+ nên dd có pH <7 |
|
- Tại sao phèn nhôm (CT : K2SO4 . Al2(SO4)3.24H2O) lại có vị chua ? |
- Khi cho phèn nhôm vào nước thì có quá trình điện li sau : K2SO4.Al2(SO4)3.24H2O => 2K+ + 4SO42- + 2Al3+ + 24H2O Al3+ + 3H2O ⇄ 3H+ +Al(OH)3 =>Do trong dd có ion H+ nên phèn chua có vị chua |
5, Hướng dẫn về nhà : Bài tập về nhà: Bài tập: 2, 3, 5, 6 (SGK – 14).

