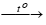Tiết 21 .Bài 14 - BÀI THỰC HÀNH 2 :
TÍNH CHẤT CỦA MỘT SỐ HỢP CHẤT NITƠ - PHOTPHO
I. MỤC TIÊU BÀI HỌC
1. Kiến thức:
Biết được: Mục đích, cách tiến hành và kĩ thuật thực hiện các thí nghiệm :
- Phản ứng của dung dịch HNO3 đặc, nóng và HNO3 loãng với kim loại đứng sau hiđro.
- Phản ứng KNO3 oxi hoá C ở nhiệt độ cao.
- Phân biệt được một số phân bón hoá học cụ thể (cả phân bón là hợp chất của photpho).
2. Kĩ năng:
- Sử dụng dụng cụ, hoá chất để tiến hành được an toàn, thành công các thí nghiệm trên.
- Quan sát hiện tượng thí nghiệm và viết các phương trình hoá học.
- Loại bỏ được một số chất thải sau thí nghiệm để bảo vệ môi trường.
- Viết tường trình thí nghiệm.
3.Thái độ: Làm thí nghiệm nghiêm túc, có tinh thần tập thể
4. Năng lực cần hướng tới :
- Năng lực chung : tự học ; giao tiếp ;hợp tác ; tư duy logic, so sánh và tổng hợp ; vận dụng kiến thức hóa học vào thực tiễn
- Năng lực riêng : tư duy hóa học ;sử dụng ngôn ngữ hóa học ;tính toán hóa học ; thực hành hóa học
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Giáo viên:
a. Dụng cụ thí nghiệm: Ống nghiệm; giá thí nghiệm ; ống nhỏ giọt ; kẹp hóa chất và đèn cồn.
b. Hóa chất: Các dd : HNO3 đặc (68%), dd HNO3 loãng (15%) ; KNO3 tinh thể, than củi. Một số loại phân bón hóa học : KCl, (NH4)2SO4, Ca(H2PO4)2.
2. Học sinh: ôn tập các kiến thức đã học để làm thí nghiệm.
III. TIẾN TRÌNH BÀI GIẢNG
1, Ổn định tổ chức : Kiểm tra sĩ số, đồng phục...
|
Lớp dạy |
|
|
Ngày dạy |
|
|
Sĩ số |
2. Kiểm tra bài cũ: Trong giờ học
3. Bài mới:
+ Bước 1: Chuyển giao nhiệm vụ học tập:
GV phát vấn học sinh về nội dung từng thí nghiệm, dự đoán hiện tượng, nhấn mạnh những nội dung, thao tác cần lưu ý.
GV cho HS quan sát thí nghiệm ảo
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Cá nhân.
+ Bước 3: Báo cáo kết quả học tập:
HS độc lập tư duy – Trình bày kết quả trước lớp qua nháp cá nhân.
HS còn lại nghe, đánh giá, bổ sung (nếu có).
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức:
I. NỘI DUNG THÍ NGHIỆM VÀ CÁCH TIẾN HÀNH
1/ Thí nghiệm 1: Tính OXH của HNO3 đặc và loãng.
- Cho 1ml HNO3 68% vào ống nghiệm 1.
- Cho 1 ml HNO3 15% vào ống nghiệm 2
→ Cho vào mỗi ống nghiệm 1 mảnh Cu, nút đầu ống nghiệm bằng bông tẩm dung dịch NaOH và đun nóng.
→ Lưu ý:
-Dùng kẹp sắt kẹp bông tẩm dung dịch NaOH tránh ăn da
- Lấy lượng ít axit để tránh tạo ra nhiều khí NO2, độc
*Quan sát hiện tượng xảy ra và giải thích.
-Cho mảnh Cu vào ống nghiệm chứa HNO3 đặc có khí NO2 màu nâu bay ra vì HNO3 đặc bị khử đến NO2. Dung dịch chuyển sang màu xanh do tạo ra Cu(NO3)2.
-Cho mảnh Cu vào ống nghiệm chứa HNO3 loãng và đun nóng có khí NO không màu bay ra, sau chuyển thành NO2 màu nâu đỏ. Dung dịch chuyển sang màu xanh lam của Cu(NO3)2
2/ Thí nghiệm 2: Tính oxi hoá KNO3 nóng chảy.
*Tiến hành: Lấy tinh thể KNO3 cho vào ống nghiệm khô đặt trên giá sắt, đun đến khí KNO3 nóng chảy, cho que đóm vào
*Quan sát, giải thích, viết phương trình hoá học:
-Que đóm sẽ bùng cháy trong KNO3 nóng chảy, có tiếng nổ lách tách đó là do KNO3 nhiệt phân giải phóng khí oxi.
- PTHH:tO
2KNO3 → 2KNO2 + O2
Oxi làm cho que đóm bùng cháy.
3/ Thí nghiệm 3: Nhận biết:
*Tiến hành: Nhận biết các dung dịch đựng trong các lọ mất nhãn đánh số 1,2,3: KCl, Na3PO4; (NH4)2SO4
*Quan sát hiện tượng và giải thích.
-Nhỏ dd NaOH vào các ống nghiệm, đun nhẹ, ốngnào có mùi khai NH3 bay ra, làm quì tím ẩm hoá xanh: nhận biết được (NH4)2SO4.
NH4+ + OH- → NH3+ H2O
- Nhỏ dd AgNO3 vào 2 ống nghiệm đựng KCl, Na3PO4, ống nghiệm nào xuất hiện kết tuả màu vàng Ag3PO4: nhận biết được Na3PO4, kết tủa trắng là KCl
II.VIẾT TƯỜNG TRÌNH THÍ NGHIỆM
|
Tên thí nghiệm |
Dụng cụ và hóa chất |
Nội dung tiến hành |
Hiện tượng |
Giải thích - PTPƯ |
|
Tính oxi hóa của dd HNO3 đặc và loãng. |
2 ống nghiệm, dd HNO3 đặc và loãng (15%) , 2 mẫu kim loại Cu. Bông tẩm xút. |
- Cho dd HNO3 và loãng (1ml) vào 2 ống nghiệm . - Thêm vào mỗi ống nghiệm 1 mẫu Cu. - Đun nhẹ ống chứa axit loãng. - Đặt bông có tẩm xút lên miệng 2 ống nghiệm. |
- Dd trong 2 ống n0 chuyển sang màu xanh. - Khí màu nâu bay ra ngay ở dd đặc,không màu hóa nâu ở dd loãng. |
- Dung dịch HNO3 oxi hóa các mẫu Cu tạo dd muối Cu2+ có màu xanh. - Axit đặc giải phóng khí NO2 có màu nâu đỏ. - Axit loãng giải phóng NO không màu và hóa nâu trong không khí. Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O. 3Cu + 8HNO3 loãng 3Cu(NO3)2 + 2NO + 8H2O. 2NO + O2 → 2NO2. |
|
Tính oxi hóa của KNO3. |
Ống nghiệm. KNO3 tinh thể. Than, đèn cồn. Kẹp hóa chất. Giá thí n0. |
- Cho vào ống n0 1 thìa KNO3 tinh thể và kẹp vào giá thí n0. - Đun cho KNO3 nóng chảy. - Đốt cháy đỏ một mẫu than và cho vào ống n0 trên. |
Than nóng đỏ bùng cháy sáng trong KNO3 nóng chảy |
- 2KNO3 - Oxi sinh ra sẽ làm cho mẫu than bùng cháy sáng. - C + O2 → CO2. |
|
Phân biệt một số lọai phân bón hóa học. |
Ống n0, nước cất. Mẫu phân bón (NH4)2SO4, KCl, Ca(H2PO4)2. dd NaOH, AgNO3, đèn cồn. |
- 3 ống n0 (1), (2), (3) chứa nước cất. - Thêm 3 mẫu phân vào 3 ống n0, lắc cho tan hết. - Thêm vào ống 1 dd NaOH, đặt mẫu quỳ ẩm trên miệng ống n0, đun nhẹ. - Thêm vào 2 ống 2 và 3 dd AgNO3. |
- Các mẫu phân tan hết, được dd trong suốt. - Ống 1 có khí làm xanh giấy quỳ ẩm. - ống 2 có kết tủa trắng xuất hiện. - ống 3 không có hiện tượng gì. |
- Các mẫu phân trên là các muối tan được trong nước. - Ống 1 có NH3 bay lên làm xanh quỳ ẩm. NH4+ + OH- → NH3 + H2O. - Ống 2 tạo AgCl là chất không ta có màu trắng do Cl- + Ag+ → AgCl. - Ống 3 không có phản ứng xảy ra nên không thấy hiện tượng gì. |
4. Củng cố bài giảng: Trọng tâm
- Tính chất một số hợp chất của nitơ ;
- Tính chất một số hợp chất của photpho.
5. Bài tập về nhà:
- Hoàn thành tường trình bài thực hành, nộp cho GV
- Chuẩn bị bài sau : Ôn tập chương 2 chuẩn bị kiểm tra viết