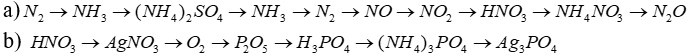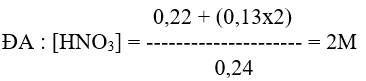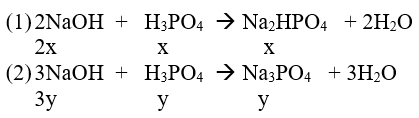Tiết 20 - LUYỆN TẬP : TÍNH CHẤT HÓA HỌC CỦA PHOTPHO
VÀ HỢP CHẤT CỦA CHÚNG
I. MỤC TIÊU BÀI HỌC
1. Kiến thức: Hệ thống hoá kiến thức về:
- Cấu hình e nguyên tử, độ âm điện, các trạng thái oxi hoá của P.
- Củng cố, ôn tập các tính chất của phôt pho, axit phôtphoric và muối phôtphát. So sánh tính chất của đơn chất và một số hợp chất của nitơ và phôt pho.
2. Kĩ năng:
- Giải bài tập axit photphoric tác dụng với dung dịch kiềm
- Giải bài toán về hỗn hợp kim loại, oxit tác dụng với HNO3, tính nồng độ axit
- Giải bài tập hiệu suất phản ứng phản ứng
3. Tư tưởng: Phát huy tinh thần đoàn kết trong hoạt động nhóm
4. Năng lực cần hướng tới :
- Năng lực chung : tự học ; giao tiếp ;hợp tác ; tư duy logic, so sánh và tổng hợp ; vận dụng kiến thức hóa học vào thực tiễn
- Năng lực riêng : tư duy hóa học ;sử dụng ngôn ngữ hóa học ;tính toán hóa học ;
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Giáo viên: Chuẩn bị phiếu học tập gồm nội dung kiến thức cần nhớ và bài tập
2. Học sinh: Ôn tập kiến thức của chương
IV. TIẾN TRÌNH BÀI GIẢNG
1, Ổn định tổ chức : Kiểm tra sĩ số, đồng phục...
|
Lớp dạy |
|
|
Ngày dạy |
|
|
Sĩ số |
2. Kiểm tra bài cũ: Kiểm tra trong quá trình ôn tập.
3. Bài mới:
|
HOẠT ĐỘNG GV VÀ HS |
NỘI DUNG |
|
-GV hướng dẫn HS làm bản đồ tư duy để ôn tập tính chất hóa học của photpho & hợp chất của chúng - Học sinh làm việc theo nhóm : thảo luận và hoàn thành vào các bảng phụ - Giáo viên cùng cả lớp kiểm tra và bổ sung để hoàn thiện kiến thức |
I. KIẾN THỨC CẦN NHỚ 1. Tính chất của đơn chất phôt pho: - Cấu hình electron: - Độ âm điện: - Cấu tạo phân tử: - Các số oxi hóa có thể có: - Tính chất hóa học cơ bản: 2. Tính chất các hợp chất của phôt pho? - Tính chất vật lí. - Tính chất hóa học. - Điều chế. - Nhận biết |
|
II. BÀI TẬP + Bước 1: Chuyển giao nhiệm vụ học tập: Bài 1: Viết phương trình dạng phân tử và ion thu gọn: 1. K3PO4 + Ba(NO3)2 → 2. Ca(H2PO4)2 + Ca(OH)2 →. 3. (NH4)3PO4 + Ba(OH)2 → Bài 2 : Khi cho 3,00 gam hỗn hợp Cu và Al tác dụng với dd HNO3 đặc, dư, đun nóng, sinh ra 4,48 lít khí duy nhất NO2 (đktc). Tính %(m) của mỗi kim loại trong hh? + Bước 2: Học sinh thực hiện nhiệm vụ học tập: Cá nhân. + Bước 3: Báo cáo kết quả học tập: HS độc lập tư duy – Trình bày kết quả trước lớp qua nháp cá nhân. HS còn lại nghe, đánh giá, bổ sung (nếu có). + Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập. GV chuẩn xác kiến thức: Bài 1: Viết phương trình dạng phân tử và ion thu gọn: 1. K3PO4 + 3Ba(NO3)2 → Ba3(PO4)2↓+ 3KNO3. PT ion :PO43- + 3Ba2+ → Ba3(PO4)2↓ 2. Ca(H2PO4)2 + Ca(OH)2 →2CaHPO4 + 2H2O. PT ion : Ca2+ + 2H2PO4- + Ca2+ + 2OH- → 2CaHPO4 + 2H2O. 3. 2(NH4)3PO4 + 3Ba(OH)2 → Ba3(PO4)2↓ + 6NH3 + 6H2O. PT ion : 6NH4+ + 2PO43- + 3Ba2+ + 6OH- → Ba3(PO4)2↓ + 6NH3 + 6H2O. Bài 2 : Khi cho 3,00 gam hỗn hợp Cu và Al tác dụng với dd HNO3 đặc, dư, đun nóng, sinh ra 4,48 lít khí duy nhất NO2 (đktc). Tính %(m) của mỗi kim loại trong hh? Hướng dẫn : Cu - 2e → Cu+2. Al - 3e → Al+3. N+5 + 1e → N+4. nNO2 = 4,48/22,4 = 0,2 mol. Đặt nCu = x và nAl = y, theo đinh luật bảo toàn mol electron ta có : 2x + 3y = 0,2 (1) 64x + 27y = 3,00 (2) Giải (1) và (2) được:x = 0,026mol ;y = 0,049mol => %(m)Cu = 55,5% ; %(m)Al = 44,5%. Bài 3 : Cho 6,00 gam P2O5 vào 25,0ml dd H3PO4 6,00% (D = 1.03g/ml). Tính nồng độ % của dd H3PO4 tạo ra ? Giải: P2O5 + 3H2O = 2H3PO4. nP2O5= 0,042mol → nH3PO4 = 0,084 + 0,016 = 0,1mol.→ mH3PO4 =0,1x 98 = 9,8 gam. C% H3PO4 = 30,9%. Bài 4 : Cần bón bao nhiêu kg đạm chứa 97,5% NH4NO3 cho 10,0 hecta khoai tây , biết 1 kg khoai tây cần 60,0 kg Nitơ ? Giải: 1,00 hecta khoai tây cần 60,0 kg Nitơ 10,00 ---------------------600,0--------- 1 kg đạm chứa 0,975kg NH4NO3 tức là có (0,975:80).28 = 0,34 kg N. → m đạm = 600,0 : 0,34 = 1758,2 kg. |
|
|
Bài 5 : Viết phương trình hoá học thực hiện dãy chuyển hoá sau:
|
|
|
Bài 6 : Cho một lượng 8,32 gam Cu tác dụng vừa đủ với 240 ml dung dịch HNO3 cho 4,928 lit hỗn hợp khí NO và NO2 bay ra (đkc). Tính nồng độ mol/l của dung dịch axit ban đầu?
|
|
|
Bài 7 : Cho 44g NaOH vào dung dịch chứa 39,2g H3PO4 . Sau khi phản ứngxảy ra hoàn toàn , đem cô cạn dung dịch , hỏi muối nào được tạo thành , khối lượng là bao nhiêu ? HD: HD : nNaOH = 44/40 = 1,1 mol ; nH3PO4 = 39,2/98= 0,4 mol xét tỉ lệ :nNaOH/ nH3PO4 = 2,75 => pư tạo hai muối sau :
- Gọi số mol của H3PO4tham gia các pư (1&2) là x & y , ta có hpt : (4) x + y = 0,4 (5) 2x + 3y = 1,1 -Giải hpt (4,5) , ta có : x = 0,1 ; y = 0,3 => m Na2HPO4 = 0,1 . 142 = 14,2 gam => m Na3PO4 = 0,3.164= 49,2 gam |
|
4. Củng cố bài giảng: Trọng tâm:
- Giải bài tập axit photphoric tác dụng với dung dịch kiềm
- Giải bài toán về hỗn hợp kim loại, oxit tác dụng với HNO3, tính nồng độ axit
- Giải bài tập hiệu suất phản ứng phản ứng
5, Hướng dẫn về nhà: Chuẩn bị nội dung bài thực hành số 2