CHƯƠNG 1 : SỰ ĐIỆN LI
TIẾT 03 – BÀI 01 : SỰ ĐIỆN LI
I. MỤC TIÊU BÀI HỌC
1, Kiến thức : Biết được: Khái niệm về sự điện li, chất điện li, chất điện li mạnh, chất điện li yếu, cân bằng điện li.
2, Kĩ năng
- Quan sát thí nghiệm, rút ra được kết luận về tính dẫn điện của dung dịch chất điện li.
- Phân biệt được chất điện li, chất không điện li, chất điện li mạnh, chất điện li yếu.
- Viết được phương trình điện li của chất điện li mạnh, chất điện li yếu.
3. Thái độ : Kích thích sự hứng thú với bộ môn, phát huy khả năng tư duy của học sinh
4. Năng lực cần hướng tới :
- Năng lực chung : tự học ; giao tiếp ; hợp tác ; tư duy logic, so sánh và tổng hợp ; vận dụng kiến thức hóa học vào thực tiễn
- Năng lực riêng : tư duy hóa học ; sử dụng ngôn ngữ hóa học ; tính toán hóa học ; thực hành hóa học
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Giáo viên: Thí nghiệm chứng minh :
- Thử tính dẫn điện của một số dung dịch
- So sánh tính dẫn điện của dd HCl 0,1M & dd CH3COOH 0,1M
2. Học sinh: Ôn lại kiến thức cơ bản của chương trình hóa học lớp 10.
III. TIẾN TRÌNH BÀI GIẢNG
1, Ổn định tổ chức : Kiểm tra sĩ số, đồng phục...
|
Lớp dạy |
|
|
Ngày dạy |
|
|
Sĩ số |
2, Kiểm tra bài cũ : Kết hợp trong bài
3, Bài mới :
3.1- Khởi động : Vì sao nước tự nhiên có thể dẫn điện được, nước cất thì không? Để tìm hiểu về điều này chúng ta sẽ tìm hiểu về nguyên nhân dẫn điện của các chất
3.2- Hình thành kiến thức mới :
Hoạt động 1: Hiện tượng điện li
+ Bước 1: Chuyển giao nhiệm vụ học tập: HS quan sát thí nghiệm ảo rồi nhận xét hiện tượng
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Cá nhân thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS xung phong trình bày kết quả.
HS khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
I- Hiện tượng điện li :
1.Thí nghiệm :
* Hiện tượng :
- Đèn sáng ở các cốc đựng : dd NaCl , dd NaOH , dd HCl
- Đèn không sáng ở các cốc đựng : nước cất , dd saccarozơ , dd ancol etylic , dd glixerol , NaCl rắn khan , NaOH rắn khan
* Kết luận :
- Không dẫn điện : : nước cất , dd saccarozơ , dd ancol etylic , dd glixerol , NaCl rắn khan , NaOH rắn khan
- Dẫn điện : dd NaCl , dd NaOH , dd HCl (dd axit , bazơ , muối)
2. Nguyên nhân tính dẫn điện của các dung dịch axit , bazơ , muối trong nước
- Nguyên nhân : Tính dẫn điện của các dung dịch axit , bazơ , muối là do trong dd của chúng có các tiểu phân mang điện tích chuyển động tự do được gọi là các ion
- Sự điện li : là quá trình phân li các chất trong nước ra ion
- Chất điện li : là những chất tan trong nước phân li ra ion => Vậy : axit , bazơ , muối là chất điện li
- Sự điện li được biểu diễn bằng phương trình điện li
- VD : NaCl => Na+ + Cl-
HCl => H+ + Cl-
NaOH => Na+ + OH-
*Chú ý : Nhiều chất khi nóng chảy cũng phân li ra ion, nên ở trạng thái nóng chảy các chất này dẫn điện được. trong phạm vi chương trình , chúng ta chỉ xét dd chất điện li
Hoạt động 2: Phân loại các chất điện li
+ Bước 1: Chuyển giao nhiệm vụ học tập: HS quan sát thí nghiệm ảo rồi nhận xét hiện tượng
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Cá nhân thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS xung phong trình bày kết quả.
HS khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
II- Phân loại các chất điện li :
1.Thí nghiệm :
* Hiện tượng : Bóng đèn ở cốc đựng dd HCl 0,1M sáng hơn ở cốc đựng dd CH3COOH 0,1M
* Kết luận : dd HCl 0,1M dẫn điện mạnh hơn dd CH3COOH 0,1M
* Nguyên nhân : nồng độ ion trong dd HCl > nồng độ ion trong dd CH3COOH , nghĩa là số phân tử HCl phân li ra ion nhiều hơn so với số phân tử CH3COOH phân li ra ion
2. Chất điện li mạnh và chất điện li yếu :
a) Chất điện li mạnh :
* KN : CĐL mạnh là chất khi tan trong nước , các phân tử hòa tan đều phân li ra ion
* CĐL mạnh bao gồm :
- Axit mạnh : HCl , HBr, HI , HNO3 , H2SO4 , HClO3 , HClO4
- Bazơ mạnh (kiềm) : là bazơ của các kim loại nhóm IA & IIA(chu kì lớn) : NaOH , KOH , Ca(OH)2 , Ba(OH)2 , ...
- Hầu hết các muối
* Chú ý :
- Trong PTĐL của CĐL mạnh , người ta dùng một mũi tên chỉ chiều của quá trình điện li
- VD : Na2SO4 => 2Na+ + SO42-
b) Chất điện li yếu :
* Khái niệm : CĐL yếu là chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li ra ion , phần còn lại vẫn tồn tại dưới dạng phân tử trong dd
* Chất điện li yếu bao gồm :
- Các axit yếu : CH3COOH , HF , H2S , HClO , HClO2 , H2CO3 , H2SO3 , …
- Các bazơ yếu : Mg(OH)2 ; …
* Chú ý :
- Trong PTĐL của CĐL yếu , người ta dùng hai mũi tên ngược chiều nhau
- VD : 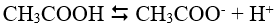
- Quá trình phân li của chất điện li yếu là quá trình cân bằng động, tuân theo nguyên lí Lơ Sa-tơ-li-ê.
3. 3- Luyện tập :
+ Bước 1: Chuyển giao nhiệm vụ học tập: HS làm bài tập 3/SGK,7.
+ Bước 2: Học sinh thực hiện nhiệm vụ học tập: Cá nhân thực hiện.
+ Bước 3: Báo cáo kết quả và thảo luận:
HS xung phong trình bày kết quả.
HS khác nghe, đánh giá, nhận xét.
+ Bước 4: Đánh giá kết quả thực hiện nhiệm vụ học tập.
GV chuẩn xác kiến thức
Bài giải :
a) Các chất điện li mạnh :
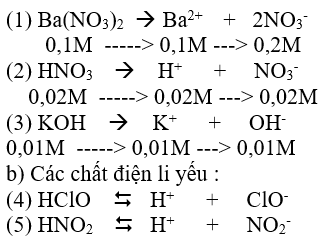
4, Củng cố: * Củng cố : Nội dung trọng tâm của bài :
- Bản chất tính dẫn điện của chất điện li (nguyên nhân và cơ chế đơn giản)
- Viết phương trình điện li của một số chất.
Vận dụng :Tại sao khi cầm dây điện để cắm hoặc rút khỏi nguồn điện ta cần lau tay khô ?
Trả Lời : Vì tay tay ướt có dính nước, nước tự nhiên có hòa tan nhiều muối khoáng là chất dẫn điện nên dễ bị điện giật
5, Hướng dẫn về nhà :
- Học bài & làm bài tập sgk ,7
- Chuẩn bị bài sau : Bài 2- Axit , bazơ & muối (Ôn tập lại ĐN và tính chất hóa học chung của axit , bazơ đã học ở THCS

