Nguyên tử oxi có 8 electron. Nguyên tử oxi có :
Nguyên tử oxi có 8 proton
Nguyên tử oxi có 2 lớp e trong đó có 6 e ở lớp ngoài cùng
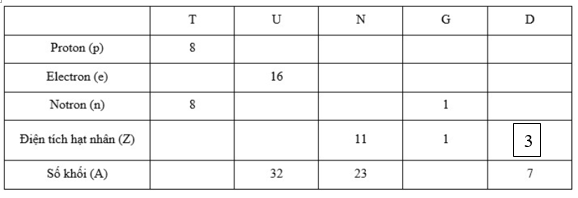
Hoàn thành bảng sau và cho biết nhận định nào không chính xác trong các nhận định sau:
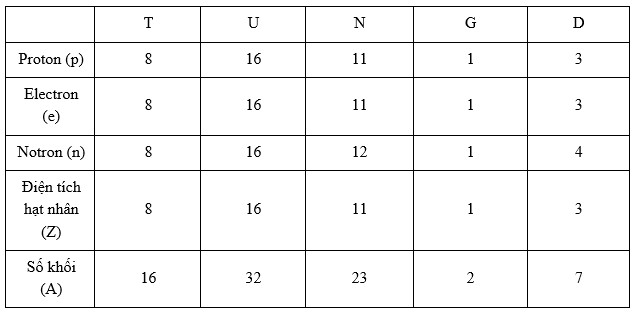
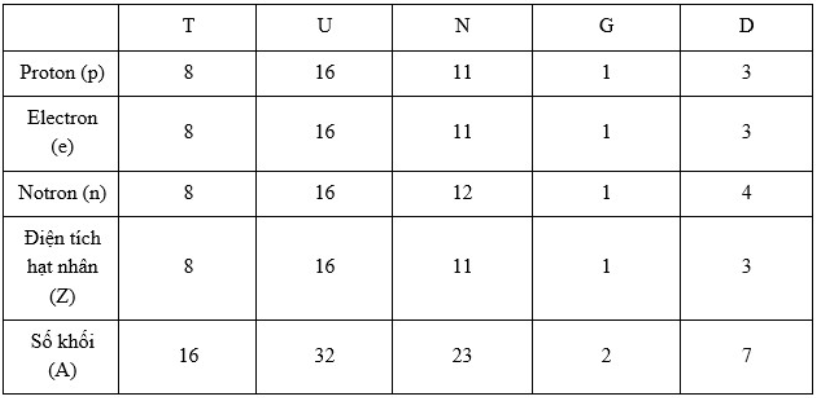
=> A, B, D đúng còn C sai
Tổng số hạt p,n,e trong 2 nguyên tử kim loại A và B là 177. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 47. Số hạt mang điện của nguyên tử B nhiều hơn của nguyên tử A là 8. Số proton của A là:
Đặt số proton, notron của A lần lượt là pA, nA
Đặt số proton, notron của A lần lượt là pB, nB
Nguyên tử trung hòa về điện nên số proton = số notron → eA = pA ; eB = pB
Tổng số hạt p,n,e trong 2 nguyên tử A, B là 142 nên ta có phương trình:
(pA + eA + nA) + (pB + eB + nB) = 177
→ 2pA + nA + 2pB + nB = 177
→ 2pA + 2pB + nA + nB = 177 (1)
Trong A, B số hạt mang điện nhiều hơn số hạt không mang điện là 47 nên ta có phương trình
(pA + eA + pB + eB) – (nA + nB) = 47
→ (2pA + 2pB) – (nA + nB) = 47 (2)
Số hạt mang điện của B nhiều hơn A là 8 nên ta có phương trình
(pB + eB) – (pA + eA) = 8
→ 2pB – 2pA = 8
→ pB – pA = 4 (3)
Từ (1) và (2) ta có hệ phương trình:
{(2pA+2pB)+(nA+nB)=177(2pA+2pB)−(nA+nB)=47⇒{2pA+2pB=112(4)nA+nB=65
Từ (3) và (4) kết hợp ta có hệ phương trình:
{−pA+pB=4(3)2pA+2pB=112(4)⇒{pA=26pB=30
Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49, trong đó số hạt không mang điện bằng 53,125% số hạt mang điện. Điện tích hạt nhân của X là:
Bước 1: Lập pt số hạt cơ bản
Tổng số hạt cơ bản trong X là 49 nên ta có: p + e + n = 49 => 2p + n = 49 (do p = e) (1)
Bước 2: Lập pt mỗi liên hệ giữa số hạt mang điện (p+e) và không mang điện (n)
Số hạt không mang điện bằng 53,125% số hạt mang điện => n=53,125%100%(p+e)hayn=53,125%100%.2p(2)
Bước 3: Giải hệ pt (1) (2) tìm p, n
Từ (1) và (2) ta có hệ phương trình: {2p+n=490,53125.2p−n=0⇒{p=16n=17
Số điện tích hạt nhân: Z = số p = 16
Ngtử của nguyên tố Y được cấu tạo bởi 36 hạt .Trong hạt nhân, hạt mang điện dương bằng số hạt không mang điện. Số proton có trong hạt nhân nguyên tử A là?
Đặt số proton, notron của nguyên tử Y lần lượt là p và n
Nguyên tử trung hòa về điện nên số e = số p = p (hạt)
Tổng số hạt trong Y là 36 → p + e + n = 36 hay 2p + n = 36 (1)
Trong hạt nhân, hạt mang điện dương bằng hạt không mang điện nên: p = n (2)
Từ (1) và (2) ta có hệ phương trình: {2p+n=36p=n⇒p=n=363=12 (hạt)
Nguyên tử của một nguyên tố A có tổng số hạt proton, nơtron, electron là 48, trong đó số hạt mang điện gấp hai lần số hạt không mang điện. Số hạt mỗi loại là:
Đặt số proton, notron lần lượt là p và n (hạt)
Nguyên tử trung hòa về điện nên số electron = số proton = p (hạt)
Trong A, tổng số hạt là 48 → p + e + n = 48 hay 2p + n = 48 (1)
Số hạt mang điện gấp hai số hạt không mang điện → (p+e) = 2n hay 2p =2n → p = n (2)
Từ (1) và (2) ta có hệ phương trình:{2p+n=48p−n=0⇒p=n=16
Vậy số hạt proton, electron, notron đều là 16 hạt
Tổng số hạt trong nguyên tử là 36, trong đó số hạt không mang điện chiếm xấp xỉ 50%. Số proton có trong nguyên tử là:
Hạt không mang điện là notron, chiếm 50% ⇒n=36×50%100%=18(hạt)
Tổng số hạt proton và electron còn lại là: 36 – 18 = 18 (hạt)
Nguyên tử trung hòa về điện nên số proton = số electron = 18/2 = 9 (hạt)
Nguyên tử M có số nơtron nhiều hơn số proton là 1 và số hạt mang điện nhiều hơn số hạt không mang điện là 10. Tổng số hạt p và n có trong nguyên tử M là:
Đặt số proton, notron lần lượt là p và n (hạt)
Nguyên tử trung hòa về điện nên số electron = số proton = p (hạt)
Trong M, số notron nhiều hơn số proton là 1 → n – p = 1 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 10 → p + e – n = 10 hay 2p – n = 10 (2)
Từ (1) và (2) ta có hệ phương trình:{n−p=1−n+2p=10⇒{n=12p=11
Tổng số hạt p và n có trong nguyên tử M là: p + n = 11 + 12 = 23
Nguyên tử Nhôm có điện tích hạt nhân là 13+. Trong nguyên tử nhôm, số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Số hạt notron của nhôm là?
Bước 1: Tính số p, e của nhôm
Số p = số e = ZAl = 13
Bước 2:
Số hạt mang điện (p+e) nhiều hơn số hạt không mang điện (n) 12 hạt
=> (p+e) - n = 12 => 26 - n = 12 => n = 14
Nguyên tử B có tổng số hạt là 28. Số hạt không mang điện chiếm 35,7%. Số proton, notron trong B lần lượt là:
Hạt không mang điện là notron, chiếm 35,7% ⇒n=28×35,7%100%=10(hạt)
Tổng số hạt proton và electron còn lại là: 28 – 10 = 18 (hạt)
Nguyên tử trung hòa về điện nên số proton = số electron = 18/2 = 9 (hạt)
Mệnh đề nào sau đây không đúng ?
(1) Số điện tích hạt nhân đặc trưng cho 1 nguyên tố.
(2) Chỉ có hạt nhân nguyên tử oxi mới có 8 proton.
(3) Chỉ có hạt nhân nguyên tử oxi mới có 8 nơtron.
(4) Chỉ có trong nguyên tử oxi mới có 8 electron.
(1) đúng
(2) đúng
(3) sai vì có thể đồng vị của nitơ cũng có 8 nơtron
(4) sai

