Tính số nguyên tử của nguyên tố H trong 1,12 lít khí A (ở đktc)
Số mol phân tử NH3 trong 1,12 lít khí (ở đktc) là:
${n_{N{H_3}}} = \frac{V}{{22,4}} = \frac{{1,12}}{{22,4}} = 0,05{\text{ }}mol$
Trong 0,05 mol NH3 có 0,05 mol N và 0,15 mol H
=> Số nguyên tử H trong 0,05 mol NH3 là: 0,15.6.1023 = 0,9.1023 (nguyên tử)
Công thức hoá học của hợp chất, biết tỉ khối của A so với hiđro là 8,5
${M_{A}} = {d_{A/{H_2}}}.{M_{{H_2}}} = 8,5.2 = 17{\text{ }}gam$
- Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mN = $\frac{{82,35.17}}{{100}}$ = 14 gam và mH = $\frac{{17,65.17}}{{100}}$ = 3 gam
- Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nN = $\frac{{14}}{{14}}$ = 1 mol và nH = $\frac{{3}}{{1}}$ = 3 mol
Vậy công thức hoá học của hợp chất là NH3
Công thức hoá học của hợp chất, biết tỉ khối của A so với hiđro là 8,5
${M_{A}} = {d_{A/{H_2}}}.{M_{{H_2}}} = 8,5.2 = 17{\text{ }}gam$
- Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mN = $\frac{{82,35.17}}{{100}}$ = 14 gam và mH = $\frac{{17,65.17}}{{100}}$ = 3 gam
- Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nN = $\frac{{14}}{{14}}$ = 1 mol và nH = $\frac{{3}}{{1}}$ = 3 mol
Vậy công thức hoá học của hợp chất là NH3
Trong các hợp chất sau, hợp chất nào có hàm lượng nitơ cao nhất?
Tư duy nhanh: hợp chất của N với O có càng nhiều nguyên tử N thì hàm lượng nito càng cao
\(\mathop N\limits^1 \mathop O\limits^1 \) \(\mathop N\limits^1 {\mathop O\limits^2 _2}\) \(\mathop {{N_2}}\limits^2 \mathop O\limits^1 \) \(\mathop {{N_2}}\limits^2 \mathop {{H_4}}\limits^{} \mathop {{O_3}}\limits^3 \)
Ta thấy tỉ lệ 2:1 trong hợp chất N2O là lớn nhất. Do vậy hàm lượng nitơ trong N2O là cao nhất.
Trong tự nhiên, sắt chủ yếu tồn tại dưới dạng hợp chất và nằm trong 4 loại quặng chính: hematit (Fe2O3), manhetit (Fe3O4), xiderit (FeCO3) và pirit (FeS2). Quặng chứa hàm lượng sắt cao nhất là:
\(\begin{array}{l}\% Fe\,(trong\,F{e_2}{O_3}) = \dfrac{{56 \times 2}}{{56 \times 2 + 16 \times 3}}.100\% = 70\% \\\% Fe\,(trong\,F{e_3}{O_4}) = \dfrac{{56 \times 3}}{{56 \times 3 + 16 \times 4}}.100\% = 72,4\% \\\% Fe\,(trong\,FeC{O_3}) = \dfrac{{56}}{{56 + 12 + 16 \times 3}}.100\% = 48,3\% \\\% Fe\,(trong\,Fe{S_2}) = \dfrac{{56}}{{56 + 32 \times 2}}.100\% = 46,67\% \end{array}\)
=> phần trăm sắt trong Fe3O4 là cao nhất
Oxit chứa 20% oxi về khối lượng và trong một oxit nguyên tố chưa biết có hoá trị II. Oxit có công thức hoá học là:
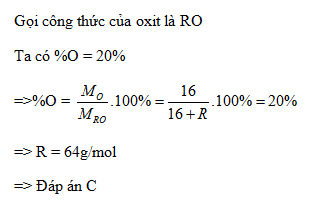
Phân tích một khối lượng hợp chất M, người ta nhận thấy thành phần khối lượng của nó có 50% là lưu huỳnh và 50% là oxi. Công thức của hợp chất M có thể là:
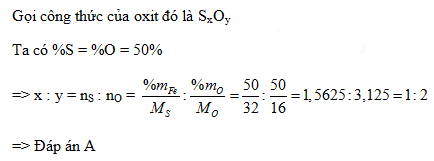
Công thức hoá học của hợp chất, biết tỉ khối của A so với hiđro là 8,5
${M_{A}} = {d_{A/{H_2}}}.{M_{{H_2}}} = 8,5.2 = 17{\text{ }}gam$
- Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mN = $\frac{{82,35.17}}{{100}}$ = 14 gam và mH = $\frac{{17,65.17}}{{100}}$ = 3 gam
- Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nN = $\frac{{14}}{{14}}$ = 1 mol và nH = $\frac{{3}}{{1}}$ = 3 mol
Vậy công thức hoá học của hợp chất là NH3
Thành phần phần trăm theo khối lượng của nguyên tố Fe có trong hợp chất Fe2O3 là
+ ${M_{F{e_2}{O_3}}}$ = 56.2 + 16.3 = 160 gam
+ Trong 1 mol Fe2O3 có: 2 mol nguyên tử Fe và 3 mol nguyên tử O
=> %mFe = $\dfrac{{2.56.100\% }}{{160}} = 70\% $
Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là
${M_{F{{\text{e}}_3}{O_4}}} = 3.56 + 4.16 = 232$
Trong 1mol Fe3O4 có 3 mol nguyên tử Fe và 4 mol nguyên tử O
=> %mFe = $\dfrac{{3.{M_{F{\text{e}}}}.100\% }}{{{M_{F{{\text{e}}_3}{O_4}}}}}$=72,4%
Thành phần phần trăm khối lượng của nguyên tố Na có trong Na2SO4 là
+) ${M_{N{a_2}S{O_4}}} = 2.23 + 32 + 16.4 = 142$
+) Trong 1 mol Na2SO4 có 2 mol nguyên tử Na ; 1 mol nguyên tử S và 4 mol nguyên tử O
+) $\% {m_{Na}} = \dfrac{{2.{M_{Na}}}}{{{M_{N{a_2}S{O_4}}}}}.100\% $$ = \dfrac{{2.23}}{{142}}.100\% = 32,39\% $
Khối lượng của mỗi nguyên tố Al và O có trong 30,6 gam Al2O3 là
${M_{A{l_2}{O_3}}} = 2.27 + 16.3 = 102$
=> 30,6 gam Al2O3 có số mol là: $\dfrac{{30,6}}{{102}} = 0,3\,mol$
Trong 1 mol Al2O3 có 2 mol nguyên tố Al và 3 mol nguyên tố O
=> trong 0,3 mol Al2O3 có 0,3.2 = 0,6 mol nguyên tố Al và 0,9 mol nguyên tố O
=> khối lượng nguyên tố Al là: 0,6.27 = 16,2 gam
Khối lượng nguyên tố O là: 0,9.16 = 14,4 gam
Tính tỉ số về khối lượng giữa các nguyên tố trong hợp chất Ca(OH)2
Trong 1 mol Ca(OH)2 có: 1 mol nguyên tử Ca, 2 nguyên tử O và 2 nguyên tử H
=> khối lượng của Ca là: 1.40 = 40 gam
Khối lượng của O là: 2.16 = 32 gam
Khối lượng của H là: 2.1 = 2 gam
=> tỉ số khối lượng giữa các nguyên tố là: 40 : 32 : 2 = 20 : 16 : 1
Hợp chất A có khối lượng mol là 94, có thành phần các nguyên tố là: 82,98% K; còn lại là oxi. Công thức hoá học của hợp chất A là
Hợp chất A gồm K và O mà %K = 82,98% => %O = 100% - 82,98% = 17,02%
Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mK = $\dfrac{{94.82,98}}{{100}}$ = 78 gam và mO = $\dfrac{{94.17,02}}{{100}}$ = 16 gam
=> Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nK = $\dfrac{{78}}{{39}}$ = 2 mol
nO = $\dfrac{{16}}{{16}}$ = 1 mol
Vậy công thức hoá học của hợp chất là K2O
Một hợp chất khí A có thành phần về khối lượng của các nguyên tố là 40% S và 60% O. Hãy xác định công thức hóa học của hợp chất khí A biết A có tỉ khối so với khí H2 là 40?
Gọi công thức hóa học cần tìm của A là SxOy
Ta có: $\% {m_S} = \dfrac{{32{\text{x}}}}{{32{\text{x}} + 16y}}.100\% = 40\% $ và $\% {m_O} = \dfrac{{16y}}{{32{\text{x}} + 16y}}.100\% = 60\% $
$ = > \dfrac{{\% {m_S}}}{{\% {m_O}}} = \dfrac{{\dfrac{{32{\text{x}}}}{{32{\text{x}} + 16y}}}}{{\dfrac{{16y}}{{32{\text{x}} + 16y}}}} = \dfrac{{40\% }}{{60\% }} = > \dfrac{{32{\text{x}}}}{{16y}} = \dfrac{2}{3} = > \dfrac{x}{y} = \dfrac{1}{3}$ (1)
+) A có tỉ khối so với khí H2 là 40 => MA = 40.MH2 = 80
=> ${M_{{S_x}{O_y}}} = 32{\text{x}} + 16y = 80\,\,\,(2)$
Từ (1) và (2) => x = 1 và y = 3
Vậy công thức hóa học của A là SO3
Một cửa hàng có bán một số loại phân đạm có công thức hóa học sau: ure: CO(NH2)2; amoni sunfat: (NH4)2SO4; amoni nitrat: NH4NO3; canxi nitrat: Ca(NO3)2. Bác nông dân không biết phải mua loại phân đạm nào có hàm lượng nguyên tố N cao nhất để bón cho ruộng. Em hãy giúp bác nông dân lựa chọn.
+) ${M_{CO{{(N{H_2})}_2}}} = 12 + 16 + (14 + 2).2 = 60$
=> Phần trăm khối lượng của N trong CO(NH2)2 là:
$\% N = \frac{{2.{M_N}}}{{{M_{CO{{(N{H_2})}_2}}}}}.100\% = \frac{{2.14}}{{60}}.100\% = 46,67\% $
+) ${M_{{{(N{H_4})}_2}S{O_4}}} = (14 + 4).2 + 32 + 16.4 = 132$
=> Phần trăm khối lượng của N trong (NH4)2SO4 là:
$\% N = \frac{{2.{M_N}}}{{{M_{{{(N{H_4})}_2}S{O_4}}}}}.100\% = \frac{{2.14}}{{132}}.100\% = 21,21\% $
+) ${M_{N{H_4}N{O_3}}} = 14 + 4 + 14 + 16.3 = 80$
=> $\% N = \frac{{2.{M_N}}}{{{M_{N{H_4}N{O_3}}}}}.100\% = \frac{{2.14}}{{80}}.100\% = 35\% $
+) ${M_{Ca{{(N{O_3})}_2}}} = 40 + (14 + 16.3).2 = 164$
=> $\% N = \frac{{2.{M_N}}}{{{M_{Ca{{(N{O_3})}_2}}}}}.100\% = \frac{{2.14}}{{164}}.100\% = 17,07\% $
Vậy phân có hàm lượng nguyên tố N cao nhất là ure: CO(NH2)2
A là hợp chất CxHy có tỉ khối hơi đối với H2 là 15 biết cacbon chiếm 80% khối lượng phân tử. Công thức phân tử của CxHy là
A có tỉ khối so với H2 là 15 => khối lượng phân tử của A là: MA = 15.2 = 30
=> ${M_{{C_x}{H_y}}}$ = 12x + y = 30 (1)
Nguyên tố C chiếm 80% về khối lượng => $\% {m_C} = \dfrac{{x.{M_C}}}{{{M_{{C_x}{H_y}}}}}.100\% = \dfrac{{12{\text{x}}}}{{12{\text{x}} + y}}.100\% = 80\% $
=> 12x = 0,8.(12x + y) => 2,4x = 0,8y (2)
Từ (1) và (2) ta có hệ phương trình: $\left\{ \begin{gathered}12{\text{x}} + y = 30 \hfill \\2,4{\text{x}} = 0,8y \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered}x = 2 \hfill \\y = 6 \hfill \\ \end{gathered} \right.$
Vậy công thức hóa học của A là: C2H6
Một hợp chất khí có thành phần phần trăm theo khối lượng là: 82,35%N và 17,65% H. Em hãy cho biết:
Công thức hoá học của hợp chất, biết tỉ khối của A so với hiđro là 8,5
${M_{A}} = {d_{A/{H_2}}}.{M_{{H_2}}} = 8,5.2 = 17{\text{ }}gam$
- Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mN = $\frac{{82,35.17}}{{100}}$ = 14 gam và mH = $\frac{{17,65.17}}{{100}}$ = 3 gam
- Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nN = $\frac{{14}}{{14}}$ = 1 mol và nH = $\frac{{3}}{{1}}$ = 3 mol
Vậy công thức hoá học của hợp chất là NH3
Một hợp chất khí có thành phần phần trăm theo khối lượng là: 82,35%N và 17,65% H. Em hãy cho biết:
Tính số nguyên tử của nguyên tố H trong 1,12 lít khí A (ở đktc)
Số mol phân tử NH3 trong 1,12 lít khí (ở đktc) là:
${n_{N{H_3}}} = \frac{V}{{22,4}} = \frac{{1,12}}{{22,4}} = 0,05{\text{ }}mol$
Trong 0,05 mol NH3 có 0,05 mol N và 0,15 mol H
=> Số nguyên tử H trong 0,05 mol NH3 là: 0,15.6.1023 = 0,9.1023 (nguyên tử)
Trong các hợp chất sau, hợp chất nào có hàm lượng sắt cao nhất?
a. FeO b. Fe2O3 c. Fe3O4 d. FeSO4 e. FeS2.


