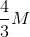Tính khối lượng NaOH có trong 200 gam dung dịch NaOH 15%
Áp dụng công thức tính khối lượng chất tan: ${{m}_{ct}}=\frac{{{m}_{dd}}.C\%}{100\%}$
=> mNaOH = $\frac{200.15\%}{100\%}$= 30 gam
Hoà tan 20 gam muối vào nước được dung dịch có nồng độ 10%
Khối lượng dung dịch nước muối thu được là
Áp dụng công thức: ${{m}_{dd}}=\frac{{{m}_{ct}}.100\%}{C\%}=\frac{20.100\%}{10\%}=200\,gam$
Hoà tan 20 gam muối vào nước được dung dịch có nồng độ 10%
Tính khối lượng nước cần dựng cho sự pha chế
Khối lượng dung dịch = khối lượng nước + khối lượng chất tan (muối)
=> mnước = mdd – mmuối = 200 - 20 = 180 gam
Số mol chất tan có trong 400 ml NaOH 6M là
Đổi 400 ml = 0,4 lít
+ Công thức tính số mol chất tan: n = CM . V
=> nNaOH = 6.0,4 = 2,4 mol
Trong 200 ml dung dịch có hoà tan 16 gam NaOH. Tính nồng độ mol của dung dịch.
Đổi: 200 ml = 0,2 lít
nNaOH = $\frac{16}{40}=0,4\,mol$
Áp dụng công thức tính nồng độ mol của dung dịch: \({{C}_{M}}=\frac{n}{{{V}_{dd}}}=\frac{0,4}{0,2}=2M\)
Tính khối lượng của Ba(OH)2 có trong 300 ml dung dịch Ba(OH)2 0,4M.
Đổi 300 ml = 0,3 lít
+ Công thức tính số mol chất tan: n = CM . V
=> ${{n}_{Ba{{(OH)}_{2}}}}=0,4.0,3=0,12\,mol$
=> Khối lượng Ba(OH)2 có trong dung dịch là: ${{m}_{Ba{{(OH)}_{2}}}}=0,12.171=20,52\,gam$
Hòa tan 10,6 gam Na2CO3 vào 456 ml nước thu được dung dịch A. Nồng độ mol của dung dịch A là
Đổi 456 ml = 0,456 lít
Số mol Na2CO3 là: ${{n}_{N{{a}_{2}}C{{O}_{3}}}}=\frac{10,6}{106}=0,1\,mol$
Áp dụng công thức tính nồng độ mol: \({{C}_{M}}=\frac{n}{{{V}_{dd}}}=\frac{0,1}{0,456}=0,219M\)
Cho dung dịch HCl 25% có D = 1,198 g/ml. Tính nồng độ mol của dung dịch đã cho
+) Áp dụng công thức chuyển từ nồng độ phần trăm sang nồng độ mol:
\[{{\rm{C}}_{\rm{M}}}{\rm{ = }}\frac{{{\rm{C\% }}{\rm{.10}}{\rm{.D}}}}{{\rm{M}}}\]
=> Nồng độ mol dd đã cho là:
\[{{\rm{C}}_{\rm{M}}}{\rm{ = }}\frac{{{\rm{C\% }}{\rm{.10}}{\rm{.D}}}}{{\rm{M}}}{\rm{ = }}\frac{{{\rm{25\% }}{\rm{.10}}{\rm{.1,198}}}}{{{\rm{36,5}}}}{\rm{ = 8,2(M)}}\]
Cho dung dịch NaOH 4M có D = 1,43 g/ml. Tính C% của dung dịch NaOH đã cho.
+) Đổi D = 1,43 g/ml = 1430 g/lít
+) Áp dụng công thức chuyển từ nồng độ mol sang nồng độ phần trăm: \(C\%=\frac{{{C}_{M}}.M}{{{D}_{dd}}}.100\%\)
=> \(C\%=\frac{4.40}{1430}.100\%=11,19\%\)
Hòa tan 75 gam HCl vào 225 gam nước thu được dung dịch B. C% của dung dịch B là
Khối lượng dung dịch thu được là: mdd = mct + mnước = 75 + 225 = 300 gam
Áp dụng công thức: $C\%=\frac{{{m}_{ct}}}{{{m}_{dd}}}.100\%=\frac{75}{300}.100\%=25\%$
Cho 200 gam dung dịch FeCl2 9,525%. Tính số mol FeCl2 có trong dung dịch
Áp dụng công thức tính khối lượng chất tan: ${{m}_{ct}}=\frac{C\%.{{m}_{dd}}}{100\%}$
=> Khối lượng FeCl2 có trong dung dịch là: ${{m}_{F\text{e}C{{l}_{2}}}}=\frac{9,525\%.200}{100\%}=19,05\,gam$
=> số mol FeCl2 là: ${{n}_{F\text{e}C{{l}_{2}}}}=\frac{19,05}{127}=0,15\,mol$
Cần lấy bao nhiêu gam dung dịch HNO3 2,52% để có 3,78 gam HNO3 làm thí nghiệm?
Khối lượng chất tan là: ${{m}_{HN{{O}_{3}}}}=3,78\,gam$
Áp dụng công thức tính khối lượng dung dịch: ${{m}_{dd}}=\frac{{{m}_{ct}}.100\%}{C\%}$
=> Khối lượng dung dịch HNO3 cần lấy là: ${{m}_{dd}}=\frac{3,78.100\%}{2,52\%}=150\,gam$
Với một lượng chất xác định, khi tăng thể tích dung môi thì:
Cùng một lượng chất xác định => khối lượng chất và số mol chất không thay đổi
Khi tăng thể tích dung môi => Thể tích dung môi tăng, khối lượng dung môi tăng
Nồng độ phần trăm:\(C\% = \dfrac{{m\,c\tan }}{{m\,d\,d}}.100\% \) mẫu số tăng lên khi khối lượng dung dịch tăng, còn mctan vẫn giữ nguyên => C% giảm
Nồng độ mol/lít: \({C_M} = \dfrac{n}{V}\) mẫu số V tăng, số mol n giữ nguyên => CM giảm
Hòa tan 124 gam natri oxit vào 876 ml nước (\({d_{{H_2}O}} = 1\,\,g/ml\)), phản ứng sinh ra natri hiđroxit. Nồng độ phần trăm của dung dịch thu được là:
nNa2O = 124: 62 = 2 (mol)
PTHH: Na2O + H2O → 2NaOH
Khối lượng H2O : mH2O = VH2O.d = 876.1 = 876 (g)
mdd sau= mNa2O + mH2O = 124 + 876 = 1000 (g)
Theo PTHH: nNaOH = 2nNa2O = 2.2 = 4 (mol) => mNaOH = 4. 40 = 160 (g)
\(C\% NaOH = \dfrac{{{m_{NaOH}}}}{{m{\,_{dd\,sau}}}}.100\% = \dfrac{{160}}{{1000}}.100 = 16\% \)
Hòa tan 12,5 gam CuSO4.5H2O vào 8,75 ml nước. Xác định nồng độ phần trăm dung dịch thu được. (Biết DH2O = 1 g/ml)
Khối lượng của nước là: mH2O = 8,75 . 1 = 8,75(g)
MCuSO4.5H2O = 64 + 32 + 16 . 4 + 5 . (1. 2 + 16) = 250(g/mol)
⟹nCuSO4.5H2O = 12,5 : 250 = 0,05(mol)
⟹nCuSO4= nCuSO4.5H2O = 0,05(mol) ⟹mCuSO4 = 0,05 . 160 = 8(g)
Khối lượng dung dịch sau là: mdd sau= 12,5 + 8,75 = 21,25(g)
\(C{\% _{CuS{O_4}}} = \frac{8}{{21,25}}.100\% = 37,65\% \)
Xác định nồng độ phần trăm của 10 ml dung dịch HCl 10,81M có khối lượng riêng d=1,19 gam/ml
10ml = 0,01 (lít)
Số mol của HCl là: nHCl = CM. V= 10,81. 0,01 = 0,1081(mol).
⟹ mHCl = 0,1081. 36,5 = 3,94565(g)
Khối lượng dung dịch HCl là: mdd HCl= V.d= 10. 1,19=11,9 (g)a
\(C\% = \frac{{{m_{HCl}}}}{{{m_{{\rm{dd}}HCl}}}}.100\% = \frac{{3,94565}}{{11,9}}.100\% = 33,16\% \)
Dung dịch HCl bán trên thị trường có nồng độ phần trăm cao nhất là 37%, khối lượng riêng D = 1,19 g/ml. Hãy tính nồng độ mol/l của 10 ml dung dịch trên
Khối lượng dung dịch HCl 37% là: mdd HCl= 1,19 . 10 = 11,9 (g)
Khối lượng chất tan có trong 11,9 g dung dịch HCl 37% là:
\({m_{HCl}} = \frac{{{m_{dd\,HCl}}}}{{100\% }}.37\% = \frac{{11,9}}{{100}}.37 = 4,403\,(g) \Rightarrow {n_{HCl}} = \frac{{4,403}}{{36,5}} = 0,12063\,(mol)\)
⟹CM = n : V = 0,12063 : 0,01 = 12,06 M
Cho 23 g Na tan hoàn toàn trong 100 g H2O thu được dung dịch A và khí B. Nồng độ phần trăm của chất tan có trong dung dịch A là:
nNa= 23: 23=1 (mol)
Na+ H2O → NaOH + \(\frac{1}{2}\)H2
Theo phương trình:
nNaOH = nNa = 1(mol)
n H2 = 1 : 2 = 0,5 (mol)
⟹mNaOH= 1.40 = 40(g)
Khối lương dung dịch sau: mdd SAU = m Na + m H2O - H2 = 122(g)
Nồng độ phần trăm của NaOH là: \(C{\% _{NaOH}} = \frac{{40}}{{122}}.100\% = 32,78\% \)
Trong 150 ml dd có hoà tan 8 gam NaOH. Nồng độ mol của dung dịch là:
Đổi: 150ml = 0,15lit
nNaOH = 8 : 40 = 0,2 mol
CM = n : V = 0,2 : 0,15 = 4/3M
Hòa tan 4,7g K2O vào 195,3 g nước. Nồng độ phần trăm dung dịch thu được là
nK2O= 4,7:94=0,05(mol)
Khối lượng dung dịch sau là: 4,7+ 195,3=200(g)
K2O + H2O → 2KOH
Theo phương trình: nKOH= 2nK2O= 2.0,05=0,1(mol)
Khối lượng KOH là: mKOH=0,1.56=5,6(mol)
\(C{\% _{KOH}} = \frac{{{m_{KOH}}}}{{{m_{{\rm{dd}}sau}}}}.100\% = \frac{{5,6}}{{200}}.100\% = 2,8\% \)