Cần bao nhiêu gam oxi để đốt cháy hết 2 mol lưu huỳnh?
PTHH: S + O2 $\xrightarrow{{{t}^{o}}}$ SO2
Tỉ lệ PT: 1mol 1mol
Phản ứng: 2mol → 2mol
=> Khối lượng oxi cần dùng là: ${{m}_{{{O}_{2}}}}=n.M=2.32=64\,gam$
Chất nào sau đây cháy mạnh trong khí oxi, sáng chói, tạo ra các hạt nóng chảy màu nâu?
Fe cháy mạnh trong khí oxi, sáng chói, tạo ra các hạt nóng chảy màu nâu là Fe3O4
PTHH: 3Fe + 2O2 $\xrightarrow{{{t}^{o}}}$ Fe3O4
Người ta điều chế oxi trong phòng thí nghiệm bằng cách nào sau đây?
- O2 điều chế bằng phản ứng phân hủy những hợp chất giàu oxi và không bền nhiệt như KMnO4, KClO3, H2O2,…
2KMnO4 $\xrightarrow{{{t}^{o}}}$ K2MnO4 + MnO2 + O2
2KClO3 $\xrightarrow[Mn{{O}_{2}}]{{{t}^{o}}}$ 2KCl + 3O2
Chất nào sau đây dùng để điều chế khí oxi trong công nghiệp?
Điều chế khí oxi trong công nghiệp, người ta điện phân nước: 2H2O → 2H2 + O2
Đốt cháy 6,2 gam P trong bình chứa 6,72 lít khí oxi (đktc) tạo thành P2O5.
Chất nào còn dư, chất nào hết?
Số mol của Photpho là: ${{n}_{P}}=\dfrac{{{m}_{P}}}{{{M}_{P}}}=\dfrac{6,2}{31}=0,2\,mol$
Số mol oxi là: ${{n}_{{{O}_{2}}}}=\dfrac{V}{22,4}=\dfrac{6,72}{22,4}=0,3\,mol$
Phương trình phản ứng: 4P + 5O2 $\xrightarrow{{{t}^{o}}}$ 2P2O5
Xét tỉ lệ phản ứng số mol chia cho hệ số phản ứng, ta có: $\dfrac{0,2}{4}<\dfrac{0,3}{5}$
=> oxi dư, P phản ứng hết => phản ứng tính theo O
Đốt cháy 6,2 gam P trong bình chứa 6,72 lít khí oxi (đktc) tạo thành P2O5.
Khối lượng chất tạo thành là bao nhiêu?
Khối lượng chất tạo thành ta dựa vào số mol của Photpho, là chất phản ứng vừa đủ
4P + 5O2 $\xrightarrow{{{t}^{o}}}$ 2P2O5
4mol 2mol
0,2mol ?mol
Số mol P2O5 tạo thành là: ${{n}_{{{P}_{2}}{{O}_{5}}}}=\dfrac{0,2.2}{4}=0,1\,mol$
Khối lượng P2O5 tạo thành là: ${{m}_{{{P}_{2}}{{O}_{5}}}}={{n}_{{{P}_{2}}{{O}_{5}}}}.{{M}_{{{P}_{2}}{{O}_{5}}}}=0,1.(31.2+16.5)=14,2\,gam$
Tính số gam kali clorat cầm thiết để điều chế được 48 gam khí oxi?
Số mol khí oxi thu được là: ${{n}_{{{O}_{2}}}}=\frac{48}{32}=1,5\,mol$
PTHH: 2KClO3 $\xrightarrow{{{t}^{o}}}$ 2KCl + 3O2
Tỉ lệ theo PT: 2mol 3mol
Phản ứng: 1mol ← 1,5mol
=> Khối lượng KClO3 cần dùng là: ${{m}_{KCl{{O}_{3}}}}=n.M=1.(39+35,5+16.3)=122,5\,gam$
Đốt cháy hoàn toàn 24 kg than đá có chứa 0,5% tạp chất lưu huỳnh và 1,5% tạp chất khác không cháy được. Tính thể tích khí CO2 và SO2 tạo thành (ở điều kiện tiêu chuẩn)
Trong than đá chứa: Cacbon (x%), lưu huỳnh (0,5%) và tạp chất khác (1,5%)
=> x = 100 – 0,5 – 1,5 = 98 (%)
=> trong 24 kg than đá chứa: 24.98% = 23,52 kg = 23520 gam cacbon; 24.0,5% = 0,12 kg = 120 gam lưu huỳnh; 24.1,5% = 0,36 kg = 360 gam tạp chất khác
=> số mol C là: ${{n}_{C}}=\dfrac{23520}{12}=1960\,mol$
Số mol S là: ${{n}_{S}}=\dfrac{120}{32}=3,75\,mol$
PTHH: C + O2 $\xrightarrow{{{t}^{o}}}$ CO2
Tỉ lệ PT: 1mol 1mol
Phản ứng: 1960mol → 1960mol
=> Thể tích khí CO2 sinh ra là: ${{V}_{C{{O}_{2}}}}=22,4.1960=43904$ lít
PTHH: S + O2 $\xrightarrow{{{t}^{o}}}$ SO2
Tỉ lệ PT: 1mol 1mol
Phản ứng: 3,75mol → 3,75mol
=> Thể tích khí SO2 sinh ra là: ${{V}_{S{{O}_{2}}}}=22,4.3,75=84$ lít
=> tổng thể tích khí thu được là: $V={{V}_{C{{O}_{2}}}}+{{V}_{S{{O}_{2}}}}=43904+84=43988$ lít
Đốt cháy m1 gam nhôm bằng 6,72 lít khí oxi (đktc) vừa đủ, thu được m2 gam Al2O3. Hòa tan toàn bộ lượng Al2O3 ở trên vào dung dịch chứa m3 gam H2SO4 vừa đủ thu được sản phẩm là Al2(SO4)3 và H2O. Tính m1 + m2 + m3
Số mol khí oxi là: ${{n}_{{{O}_{2}}}}=\frac{6,72}{22,4}=0,3\,mol$
PTHH: 4Al + 3O2 $\xrightarrow{{{t}^{o}}}$ 2Al2O3
Tỉ lệ PT: 4mol 3mol 2mol
Phản ứng: 0,4mol ← 0,3mol → 0,2mol
=> Khối lượng Al2O3 thu được là: m2 = ${{m}_{A{{l}_{2}}{{O}_{3}}}}=0,2.102=20,4\,gam$
Khối lượng Al phản ứng là: m1 = mAl = 0,4.27 = 10,8 gam
Lấy 0,2 mol Al2O3 tác dụng với H2SO4
PTHH: Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Tỉ lệ PT: 1mol 3mol
Phản ứng: 0,2mol → 0,6mol
=> Khối lượng H2SO4 phản ứng là: ${{m}_{3}}={{m}_{{{H}_{2}}S{{O}_{4}}}}=0,6.98=58,8\,gam$
=> m1 + m2 + m3 = 10,8 + 20,4 + 58,8 = 90 gam
Đốt cháy m1 gam kẽm bằng khí oxi vừa đủ, thu được 12,15 gam ZnO. Hòa tan toàn bộ lượng ZnO ở trên vào dung dịch chứa m2 gam HCl vừa đủ thu được sản phẩm là ZnCl2 và nước. Tính m1 + m2
Số mol ZnO thu được là: ${{n}_{ZnO}}=\frac{12,15}{81}=0,15\,mol$
PTHH: 2Zn + O2 $\xrightarrow{{{t}^{o}}}$ 2ZnO
Tỉ lệ PT: 2mol 1mol 2mol
Phản ứng: 0,15mol ← 0,15mol
=> Khối lượng Zn phản ứng là: m1 = mZn = 0,15.65 = 9,75 gam
Lấy 0,15 mol ZnO cho vào dung dịch HCl
PTHH: ZnO + 2HCl → ZnCl2 + H2O
Tỉ lệ PT: 1mol 2mol
P/ứng: 0,15mol → 0,3mol
=> Khối lượng HCl phản ứng là: mHCl = m2 = 0,3.36,5 = 10,95 gam
=> m1 + m2 = 9,75 + 10,95 = 20,7 gam
Đốt cháy hoàn toàn 32 gam khí metan (CH4) cần V lít khí oxi (đktc), thu được khí CO2 và H2O. Giá trị của V là
Số mol khí CH4 là: ${{n}_{C{{H}_{4}}}}=\frac{32}{12+4}=2\,mol$
PTHH: CH4 + 2O2 $\xrightarrow{{{t}^{o}}}$ CO2 + 2H2O
Tỉ lệ PT: 1mol 2mol
Phản ứng: 2mol → 4mol
=> thể tích khí oxi cần dùng là: ${{V}_{{{O}_{2}}}}=22,4.n=22,4.4=89,6$ lít
Đốt cháy hoàn toàn m1 gam khí etilen (C2H4) cần 7,392 lít khí oxi (đktc), thu được m2 gam khí CO2 và m3 gam H2O. Tính m1 + m2 + m3
Số mol khí O2 là: ${{n}_{{{O}_{2}}}}=\frac{7,392}{22,4}=0,33\,mol$
Ta có PTHH: C2H4 + 3O2 2CO2 + 2H2O
Theo phương trình cứ 3 mol O2 thì đốt cháy hết 1 mol C2H4
Theo đầu bài………………0,33 mol O2…...$\frac{{0,33}}{3}$= 0,11mol C2H4
Áp dụng định luật bảo toàn khối lượng ta có: m C2H4 + mO2 = mCO2 + mH2O
=> mCO2 + mH2O = 0,11.28 + 0,33.32=13,64
=> m1 + m2 + m3 = m C2H4 + mCO2 + mH2O = 13,64 + 3,08= 16,72 gam
Đốt cháy 7,8 gam khí axetilen (C2H2) trong khí oxi, thu được 11,2 lít khí CO2 (đktc) và m2 gam H2O. Giá trị m2 là
Số mol khí C2H2 là: ${{n}_{{{C}_{2}}{{H}_{2}}}}=\frac{7,8}{12.2+2}=0,3\,mol$
Số mol khí CO2 là: ${{n}_{C{{O}_{2}}}}=\frac{11,2}{22,4}=0,5\,mol$
Vì đầu bài cho 2 số liệu số mol của chất phản ứng C2H2 và chất sản phẩm CO2 => tính toán theo chất sản phẩm
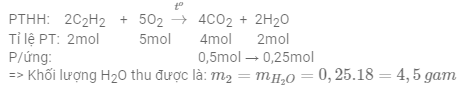
Khí được con người sử dụng để hô hấp là:
Con người hít khí O2 vào cơ thể để hô hấp
Oxi phản ứng với nhóm chất nào dưới đây ?
A. Loại Cl2 không pư.
B. Thỏa mãn
PTHH minh họa: C + O2 \(\xrightarrow{{{t^0}}}\) CO2
C2H2 + 5/2O2 \(\xrightarrow{{{t^0}}}\) 2CO2 + H2O
2Cu + O2 \(\xrightarrow{{{t^0}}}\) 2CuO
B, D. Loại Au không pư.
Khi đưa que đóm tàn đỏ vào miệng ống nghiệm chứa khí ôxi có hiện tượng gì xảy ra ?
Khi đưa que đóm tàn đỏ vào miệng ống nghiệm chứa khí ôxi thì tàn đóm bùng cháy.
Trong điều kiện bình thường, khí oxi là đơn chất hoạt động hóa học ở mức độ:
Trong điều kiện bình thường, khí oxi là đơn chất hoạt động hóa học ở mức độ: mạnh
Mỗi giờ 1 người lớn trung bình hít vào 0,5 m3 không khí, cơ thể giữ lại 1/3 lượng oxi có trong đó. Vậy thực tế trong 1 ngày đêm, cơ thể người cần 1 lượng khí oxi là:
Vì O2 chiếm 20% thể tích không khí nên trong 0,5 m3 có chứa lượng O2 là: \({V_{{O_2}}} = \frac{{20\% }}{{100\% }}.0,5 = 0,1{m^3}\)
Cơ thể người giữ lại 1/3 lượng oxi nên 1 giờ cơ thể người giữ lại lượng O2 có trong không khí là: \({V_{{O_2}giu\,lai}} = \frac{1}{3}{V_{{O_2}}} = \frac{{0,1}}{3}\,{m^3}\)
1 ngày đêm có 24 giờ nên cơ thể người cần 1 lượng oxi là: \({V_{{O_2}\,can}} = 24 \times {V_{{O_2}giu\,lai}} = 24 \times \frac{{0,1}}{3} = 0,8\,{m^3}\)
Các phát biểu sau đây là đúng hay sai?
1. Khí oxygen tan nhiều trong nước.
2. Oxygen ở thể rắn hay lỏng có màu xanh nhạt.
3. Ở điều kiện thường, oxygen là chất khí.
1. Khí oxygen tan nhiều trong nước.
2. Oxygen ở thể rắn hay lỏng có màu xanh nhạt.
3. Ở điều kiện thường, oxygen là chất khí.
Ý (2), (3) đúng.
Ý (1) sai vì oxygen tan ít trong nước.

Khi đốt bếp than, bếp lò, muốn ngọn lửa cháy to hơn, ta thường thổi hoặc quạt mạnh vào bếp. Đúng hay Sai?
Khi thổi hoặc quạt sẽ cung cấp thêm khí oxi. Thổi hoặc quạt càng mạnh càng nhiều khí oxy, vì thế sự diễn ra cháy càng mạnh hơn và tỏa nhiều nhiệt hơn.
=> Đáp án: Đúng

