I. Tính acid của nitric acid
- Làm quỳ tím chuyển thành màu đỏ.
- Tác dụng với kim loại (không giải phóng H2)
- Tác dụng với oxide base.
Ví dụ: CuO + HNO3 → Cu(NO3)2 + H2O
- Tác dụng với base.
Ví dụ: Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
- Tác dụng với muối của acid yếu hơn tạo muối nitrate.
Ví dụ: CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
II. Nitric acid tác dụng với kim loại
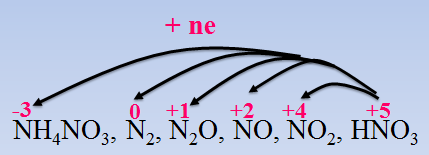
- Nitric acid là một trong những acid có tính oxi hóa mạnh. Tùy thuộc vào nồng độ của acid và độ mạnh yếu của chất khử mà HNO3 có thể bị khử đến những sản phẩm khử khác nhau của nitrogen.
- Nitric acid oxi hóa hầu hết các kim loại (trừ Au, Pt), kim loại bị oxi hóa lên số oxh cao nhất, tạo muối nitrate.
PTHH tổng quát:
M+HNO3→M(NO3)n+[NO2NON2ON2NH4NO3+H2O
- HNO3 đặc sản phẩm khử là NO2.
- HNO3 loãng :
+ kim loại có tính khử TB, yếu (Fe, Cu, Ag,...) sản phẩm khử là NO.
+ kim loại có tính khử mạnh như (Mg, Al, Zn,…) sản phẩm khử là NO, N2O, N2, NH4NO3.
- HNO3 đặc nguội không tác dụng với Al, Fe, Cr
Ví dụ:
0Zn + 4H+5NO3 dac → +2Zn(NO3)2 + 2+4NO2 + 2H2O
30Cu + 8H+5NO3loãng → +23Cu(NO3)2 + 2+2NO + 4H2O
80Al + 30H+5NO3→ 8+3Al(NO3)3+ 3−3NH4NO3+ 9H2O
Các kim loại như Al, Cr, Fe bị thụ động trong dung dịch HNO3 đặc nguội, do tạo ra một lớp màng oxide bền, bảo vệ cho kim loại khỏi tác dụng của các acid.
Video thí nghiệm kim loại tác dụng với HNO3
III. Nitric acid tác dụng với phi kim và hợp chất
1. Nitric acid tác dụng với phi kim
Khi đun nóng, HNO3 đặc có thể oxi hóa được các phi kim như C, S, P... lên mức oxi hóa cao nhất.
Ví dụ:
0S + 6H+5NO3→ H2+6SO4 + 6+4NO2 + 2H2O
0C + 4+5HNO3 → +4CO2 + 4+4NO2 + 2H2O
Video thí nghiệm lưu huỳnh tác dụng với HNO3
2. Nitric acid tác dụng với hợp chất (có tính khử)
HNO3 oxi hóa nhiều hợp chất có tính khử như H2S, SO2, FeO, muối sắt (II)…
Ví dụ:
+2FeO+4H+5NO3đặc→+3Fe(NO3)3++4NO2+2H2O
3H2−2S+2H+5NO3loãng→02S++22NO+4H2O
HNO3 đặc còn oxi hóa được nhiều hợp chất vô cơ và hữu cơ. Vải, giấy, mùn cưa, dầu thông... bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc.
IV. Ứng dụng và điều chế nitric acid
1. Ứng dụng
Nitric acid là một trong những hóa chất cơ bản và quan trọng.
- Phần lớn nitric acid được sản xuất ra dùng để điều chế phân đạm NH4NO3, Ca(NO3)2...
- Một lượng nhỏ nitric acid dùng để sản xuất thuốc nổ, thuốc nhuộm, dược phẩm...

2. Điều chế
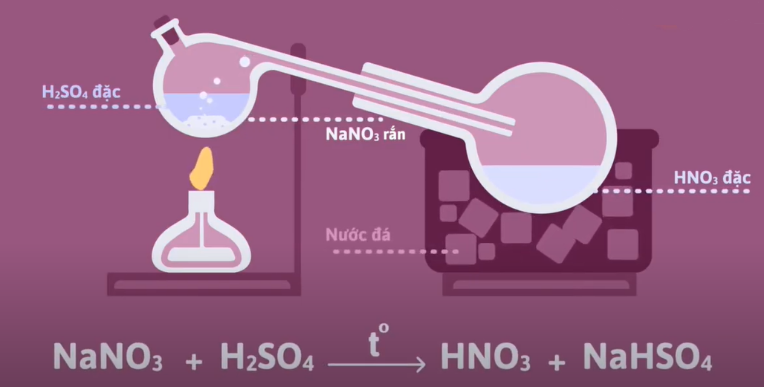
a. Trong phòng thí nghiệm
Để điều chế một lượng nhỏ nitric acid trong phòng thí nghiệm, người ta đun hỗn hợp sodium nitrate (NaNO3) hoặc potassium nitrate (KNO3) rắn với sulfuric acid.
Hơi HNO3 thoát ra được dẫn vào bình làm lạnh và ngưng tụ.
b. Trong công nghiệp
NH3+O2,t0,xt→GD1NO+O2→GD2NO2+O2+H2O→GD3HNO3

