Liên kết đôi C=C gồm 1 liên kết δ và 1 liên kết π. Liên kết π kém bền hơn liên kết δ nên dễ bị phân cắt hơn, gây nên tính chất hóa học đặc trưng của anken: dễ tham gia phản ứng cộng tạo thành hợp chất no tương ứng.
1. Cộng H2
${{C}_{n}}{{H}_{2n}}(anken)+{{H}_{2}}\xrightarrow{{{t}^{o}},\text{ Ni}}{{C}_{n}}{{H}_{2n+2}}(ankan)$
Ví dụ $C{{H}_{2}}=C{{H}_{2}}+{{H}_{2}}\xrightarrow{{{t}^{o}},\text{ Ni}}C{{H}_{3}}-C{{H}_{3}}$
2. Cộng halogen (Br2, Cl2)
CnH2n + Br2 $\xrightarrow{{}}$ CnH2nBr2
(vàng nâu) (không màu)
Ví dụ: $C{{H}_{3}}-CH=C{{H}_{2}}+B{{r}_{2}}\xrightarrow{{}}C{{H}_{3}}-CHBr-C{{H}_{2}}Br$
* Phản ứng dùng để nhận biết anken
3. Cộng HX (X là OH, Cl, Br,...)
Ví dụ: $C{{H}_{2}}=C{{H}_{2}}+HCl\xrightarrow{{}}C{{H}_{3}}-C{{H}_{2}}Cl$
$C{{H}_{2}}=C{{H}_{2}}+{{H}_{2}}O\xrightarrow{{{H}^{+}},{{t}^{0}}}C{{H}_{3}}-C{{H}_{2}}OH$
Đối với các anken bất đối xứng khi tham gia phản ứng cộng HX có thể sinh ra hỗn hợp sản phẩm.
Quy tắc cộng Mac-côp-nhi-côp: Trong phản ứng cộng HX vào liên kết đôi, nguyên tử H (hay phần tử mang điện dương) chủ yếu cộng vào nguyên tử cacbon bậc thấp hơn (có nhiều H hơn), còn nguyên tử hay nhóm nguyên tử X (phần mang điện tích âm) cộng vào nguyên tử cacbon bậc cao hơn (có ít h hơn).
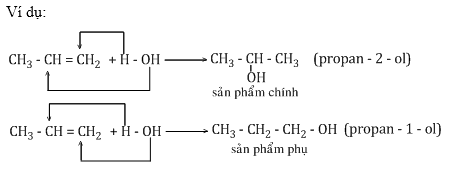
Kết luận:
- Anken đối xứng + tác nhân bất đối xứng => 1 sản phẩm
- Anken bất đối xứng + tác nhân đối xứng => 1 sản phẩm
- Anken bất đối xứng + tác nhân bất đối xứng => 2 sản phẩm
* Phương pháp giải
1. Phản ứng cộng hợp H2 (Ni, to)
Tổng quát: $(X)\left\{ \begin{gathered} anken \hfill \\ {H_2} \hfill \\ \end{gathered} \right.\xrightarrow[{H \leqslant 100\% }]{{xt,{t^o}}}(Y)\left\{ \begin{gathered} ankan \hfill \\ anken \hfill \\ {H_2} \hfill \\ \end{gathered} \right.$
+ Tùy thuộc vào hiệu suất phản ứng mà tổng hợp Y có thành phần khác nhau.
+ Theo định luật bảo toàn khối lượng: ${{m}_{X}}={{m}_{Y}}\Rightarrow \frac{{{{\bar{M}}}_{X}}}{{{{\bar{M}}}_{Y}}}=\frac{{{n}_{Y}}}{{{n}_{X}}}$
+ nhỗn hợp khí giảm = ${{n}_{{{H}_{2}}}}$(phản ứng)
+ Đốt cháy hoàn toàn hỗn hợp Y giống như đốt cháy hoàn toàn X
2. Phương pháp bảo toàn liên kết ?
Ta xem số mol liên kết π được tính bằng = số mol phân tử $\times $ số liên kết π
=> nπ = ${{n}_{{{H}_{2}}}}$phản ứng + ${{n}_{B{{r}_{2}}}}$phản ứng

