A. LƯU HUỲNH ĐIOXIT
I. TÍNH CHẤT VẬT LÝ
- Lưu huỳnh đioxit (SO2) (khí sunfurơ) là chất khí không màu mùi hắc, nặng hơn không khí (D = 64/29).
- Tan nhiều trong nước.
- Lưu huỳnh đioxit là khí độc, hít thở phải không khí có khí này sẽ gây viêm đường hô hấp.
II. TÍNH CHẤT HÓA HỌC
1. Lưu huỳnh đioxit là oxit axit
- SO2 tan trong nước tạo thanh dung dịch axit sunfurơ H2SO3
SO2 + H2O ⇆ H2SO3
- Axit sunfurơ là axit yếu, không bền, nhưng mạnh hơn axit H2S và H2CO3.
- Khí SO2 tác dụng với dd kiềm, sản phẩm tạo ra hai loại muối: muối axit và muối trung hòa.
SO2+OH−→HSO3−SO2+2OH−→SO32−+H2O
Đặt (T=nOH−nSO2)
T ≤ 1 : tạo muối axit phản ứng (1), tính theo OH-
1 < T < 2 : tạo 2 muối trung hòa và muối axit: phản ứng (1) và (2)
T ≥ 2 : tạo muối trung hòa: phản ứng (2), tính theo SO2
2. Lưu huỳnh đioxit là chất khử và chất oxi hóa
Trong hợp chất SO2, nguyên tố lưu huỳnh có số oxi hóa +4, là số oxi hóa trung gian giữa các số oxi hóa −2 và +6. Do vậy, khi tham gia phản ứng oxi hóa - khử, SO2 có thể bị khử hoặc bị oxi hóa.
a) Lưu huỳnh đioxit là chất khử
- Lưu huỳnh đioxit là chất khử khi tác dụng với những chất oxi hóa mạnh, như halogen, kali pemanganat,...
SO2 + Br2 + 2H2O → 2HBr + H2SO4
2H2O + 2KMnO4 + 5SO2 → 2H2SO4 + 2MnSO4 + K2SO4
b) Lưu huỳnh đioxit là chất oxi hóa
Lưu huỳnh đioxit là chất oxi hóa khi tác dụng với chất khử mạnh hơn.
- Khi dẫn khí SO2 vào dung dịch axit H2S dung dịch bị vẩn đục màu vàng. SO2 đã oxi hóa H2S thành S
SO2 + 2H2S → 3S + 2H2O
III. ỨNG DỤNG VÀ ĐIỀU CHẾ LƯU HUỲNH ĐIOXIT
1. Ứng dụng
- Lưu huỳnh đioxit dùng để sản xuất H2SO4 trong công nghiệp làm chất trắng và bột giấy, chất chống nấm mốc lương thực phẩm...
2. Điều chế lưu huỳnh đioxit
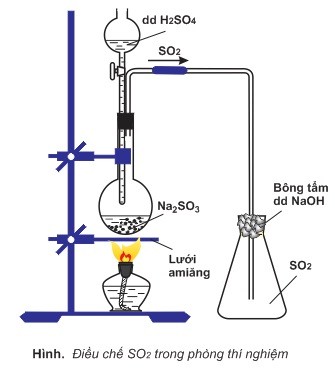
Trong phòng thí nghiệm, SO2 được điều chế bằng cách đun nóng dung dịch axit H2SO4 với muối Na2SO3 tinh thể.
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑
Thu SO2 vào bình bằng cách đẩy không khí.
- Trong công nghiệp, SO2 được điều chế bằng cách:
+ Đốt cháy lưu huỳnh.
+ Đốt quặng sunfua kim loại, như pirit sắt (FeS2): 4FeS2 + 11O2 to→ 2Fe2O3 + 8SO2↑
B. LƯU HUỲNH TRIOXIT
I. TÍNH CHẤT
- Lưu huỳnh trioxit (SO3) là chất lỏng không màu tan vô hạn trong nước và trong axit sunfuric
- SO3 là oxit axit, tác dụng rất mạnh với nước tạo ra axit sunfuric:
SO3 + H2O → H2SO4
- Lưu huỳnh trioxit tác dụng với dung dịch bazơ và oxit bazơ tạo ra muối sunfat
II. ỨNG DỤNG VÀ SẢN XUẤT
- Lưu huỳnh trioxit ít có ứng dụng trong thực tế, nhưng lại là sản phẩm trung gian để sản xuất axit sunfuric.
- Trong công nghiệp người ta sản xuất lưu huỳnh trioxit bằng cách oxi hóa lưu huỳnh đioxit
4FeS2 + 11O2 to→ 2Fe2O3 + 8SO2
2SO2 + O2 V2O5,to→ 2SO3

