I. KHÁI QUÁT VỀ NHÓM OXI - LƯU HUỲNH
- Nhóm VIA gồm các nguyên tố: O, S, Se và Te, Po.
- Cấu hình e lớp ngoài cùng: ns2np4.
- O trong hợp chất thường có mức oxi hóa -2;
- S, Se, Te ngoài mức oxi hóa -2 khi liên kết với các nguyên tố có độ âm điện lớn hơn còn có số oxi hóa +4; +6.
- Các nguyên tố trong nhóm oxi đều là nguyên tố phi kim mạnh (trừ Po), chúng có tính oxi hóa mạnh và tính oxi hóa giảm dần từ O đến Te.
- Hợp chất với H2 (H2X) trừ H2O thì đều là chất khí, mùi khó chịu và độc hại. Dung dịch trong nước của chúng có tính axit yếu.
- Hợp chất hiđroxit (H2XO4) là những axit.
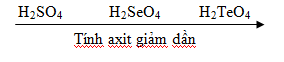
II OXI - OZON - LƯU HUỲNH
|
|
Oxi |
Ozon |
Lưu huỳnh |
|
Cấu tạo |
Cấu hình e của oxi (Z=8): 1s22s22p4 O=O: Liên kết cộng hóa trị không cực
|
Cấu hình e của oxi (Z=8): 1s22s22p4
|
S (Z=16): 1s22s22p63s23p4 Số OXH: -2 ; 0 ; +4 ; +6
|
|
Tính chất vật lí |
O2 là chất khí, không màu, ít tan trong nước.
|
O3 là chất khí, mùi đặc trưng, màu xanh nhạt.
|
Chất rắn màu vàng, không tan trong nước. Có 2 dạng thù hình: lưu huỳnh tà phương \(({S_\alpha })\) , lưu huỳnh đơn tà \(({S_\beta })\)
|
|
Tính chất hóa học |
O2 là nguyên tố phi kim hoạt động, có tính oxi hóa mạnh. - Tác dụng với hầu hết các kim loại (trừ Ag, Au, Pt…) - Tác dụng với nhiều phi kim (trừ halogen) ${{\overset{0}{\mathop{O}}\,}_{2}}+S\xrightarrow{{{t}^{0}}}S{{\overset{-2}{\mathop{O}}\,}_{2}}$ - Tác dụng với nhiều hợp chất $3{{\overset{0}{\mathop{O}}\,}_{2}}+2{{H}_{2}}S\xrightarrow{{{t}^{0}}}2S{{\overset{-2}{\mathop{O}}\,}_{2}}\uparrow +2{{H}_{2}}\overset{-2}{\mathop{O}}\,$
|
O3 có tính oxi hóa rất mạnh, mạnh hơn oxi. O3 + 2Ag → Ag2O + O2↑ O3 + 2KI + H2O→I2 + 2KOH + O2↑
|
- Vừa thể hiện tính OXH, vừa thể hiện tính khử + Tính oxi hóa: $\overset{0}{\mathop{S}}\,+Fe\xrightarrow{{{t}^{0}}}Fe\overset{-2}{\mathop{S}}\,$ $\overset{0}{\mathop{S}}\,+Hg\to Hg\overset{-2}{\mathop{S}}\,$ => Dùng S thu gom thủy ngân rơi vãi + Tính khử: ${{\overset{{}}{\mathop{O}}\,}_{2}}+\overset{0}{\mathop{S}}\,\xrightarrow{{{t}^{0}}}\overset{+4}{\mathop{S}}\,{{\overset{{}}{\mathop{O}}\,}_{2}}$
|
|
Điều chế |
- Trong công nghiệp: + Chưng cất phân đoạn không khí lỏng. + Điện phân nước: 2H2O - Trong PTN: nhiệt phân hợp chất chứa oxi 2KClO3$\xrightarrow{{{t}^{0}}}$ 2KCl + 3O2↑ 2KMnO4$\xrightarrow{{{t}^{0}}}$K2MnO4 + MnO2 + O2↑ 2H2O2$\xrightarrow{{{t}^{0}}}$2H2O + O2↑
|
|
- Khai thác lưu huỳnh trong mỏ lưu huỳnh. - Điều chế từ hợp chất: SO2 + 2H2S$\xrightarrow{{{t}^{0}}}$ 3S + 2H2O 2H2S + O2(thiếu) $\xrightarrow{{{t}^{0}}}$2S + 2H2O |
III. HIĐRO PEOXIT
H2O2 vừa có tính khử, vừa có tính oxi hóa.
- Tính oxi hóa: H2O2 + 2KI → I2 + 2KOH.
- Tính khử: 5H2O2 + 2KMnO4 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
IV. HIĐROSUNFUA
1. Tính chất vật lý:
H2S là chất khí không màu, mùi trứng thối và rất độc
2. Tính chất hóa học
- Tính axit yếu (yếu hơn H2CO3)
- Tính khử mạnh
2\({H_2}\mathop S\limits^{ - 2} \)+ SO2→ 2\(\mathop S\limits^0 \) + 2H2O
(Đun nóng 2 khí thu được chất bột màu vàng)
$2{{H}_{2}}\overset{-2}{\mathop{S}}\,+3{{O}_{2}}\xrightarrow{{{t}^{0}}}2\overset{+4}{\mathop{S}}\,{{O}_{2}}+2{{H}_{2}}O$
\({H_2}\mathop S\limits^{ - 2} \)+4Cl2 + 4H2O→\({H_2}\mathop S\limits^{ + 6} {O_4}\) + 8HCl
3. Điều chế trong PTN:
FeS + 2HCl → FeCl2 + H2S↑
H2S không điều chế trong công nghiệp vì không có ứng dụng thực tế
V. MUỐI SUNFUA
- Muối sunfua được chia thành 3 loại:
+ Loại 1. Tan trong nước và tan trong axit gồm Na2S, K2S, CaS và BaS, (NH4)2S.
+ Loại 2. Không tan trong nước nhưng tan trong axit mạnh gồm FeS, ZnS...
+ Loại 3. Không tan trong nước và không tan trong axit HCl, H2SO4 loãng gồm CuS, PbS, HgS, Ag2S...
- Màu: CdS (vàng); CuS, FeS, Ag2S, PbS…(đen); HgS (đỏ); ZnS (trắng).
VI. LƯU HUỲNH ĐIOXIT
1. Tính chất vật lí
SO2 là chất khí không màu, mùi hắc và độc.
2. Tính chất hóa học
- SO2 là oxit axit
- SO2 vừa thể hiện tính oxi hóa, vừa thể hiện tính khử:
Tính OXH: $\overset{+4}{\mathop{S}}\,{{O}_{2}}$ + 2H2S → $\overset{0}{\mathop{S}}\,$ + 2H2O
$\overset{+4}{\mathop{S}}\,{{O}_{2}}$ + 2Mg $\xrightarrow{{{t}^{0}}}$2MgO + $\overset{0}{\mathop{S}}\,$
Tính khử: $\overset{+4}{\mathop{S}}\,{{O}_{2}}$ + Br2 + 2H2O → 2HBr + ${{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}$
5$\overset{+4}{\mathop{S}}\,{{O}_{2}}$+2KMnO4 + 2H2O → K2SO4 + 2MnSO4 +2${{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}$
3. Điều chế
- Trong công nghiệp:
4FeS2 +11O2 $\xrightarrow{{{t}^{0}}}$ 2Fe2O3+ 8SO2
S + O2 $\xrightarrow{{{t}^{0}}}$SO2
- Trong PTN: Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑+ H2O
VII. LƯU HUỲNH TRIOXIT VÀ AXIT SUNFURIC
1. Tính chất vật lí
- SO3 là chất lỏng, hút nước rất mạnh và chuyển thành H2SO4 hoặc oleum: H2SO4.nSO3
- H2SO4 đặc là chất lỏng không màu, sánh như dầu, không bay hơi.
- Dễ hút ẩm → làm khô một số khí
- H2SO4 đặc tan trong nước, tỏa nhiều nhiệt → muốn pha loãng H2SO4 đặc ta phải rót từ từ axit vào nước và khuấy đều.
2. Tính chất hóa học
- H2SO4 loãng: có đầy đủ tính chất của một axit mạnh:
- H2SO4 đặc có tính oxi hóa mạnh
H2SO4 đặc, nóng oxi hóa được hầu hết các kim loại ( trừ Au,Pt), nhiều phi kim và nhiều hợp chất:
2${{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}$ đặc + \(\overset{0}{\mathop{Cu}}\,\) $\xrightarrow{{{t}^{0}}}$\(\overset{+2}{\mathop{Cu}}\,\)SO4 + \(\overset{+4}{\mathop{S}}\,\)O2 $\uparrow $ +2H2O.
6${{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}$ đặc + 8H$\overset{0}{\mathop{I}}\,$ $\xrightarrow{{{t}^{0}}}$4\(\overset{0}{\mathop{I}}\,\)2 + H2$\overset{-2}{\mathop{S}}\,$ $\uparrow $ +4H2O.
H2SO4 đặc, nóng oxi hóa kim loại lên số oxi hóa dương cao nhất:
6${{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}$ đặc + 2\(\overset{0}{\mathop{Fe}}\,\) $\xrightarrow{{{t}^{0}}}$\({{\overset{+3}{\mathop{Fe}}\,}_{2}}{{(S{{O}_{4}})}_{3}}\) + 3\(\overset{+4}{\mathop{S}}\,\)O2 $\uparrow $ +6H2O.
Chú ý: Al, Fe, Cr… không tác dụng với H2SO4 đặc, nguội.
- H2SO4 đặc có tính háo nước → Thận trọng khi sử dụng H2SO4 đặc!
3. Điều chế:
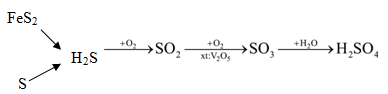
VIII. MUỐI SUNFAT
- Muối tan: Na2SO4, KHSO4, (NH4)2SO4,…
- Muối không tan: BaSO4, PbSO4,…
Nhận biết ion SO42- : thuốc thử là BaCl2 hoặc Ba(NO3)2 hoặc Ba(OH)2,…
Ba2+ +SO42- → BaSO4 trắng

 : Có 1 liên kết cho nhận
: Có 1 liên kết cho nhận