I. VỊ TRÍ NHÓM OXI TRONG BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ
– Vị trí: thuộc nhóm VIA trong bảng HTTH
– Gồm các nguyên tố: Oxi (O), lưu huỳnh (S), selen (Se), Telu (Te) và poloni (Po)
+ Oxi là nguyên tố phổ biến nhất trên trái đất, chiếm khoảng 20% thể tích không khí; ở trạng thái đơn chất, là chất khí, không màu.
+ Lưu huỳnh là chất rắn, màu vàng; có nhiều trong lòng đất
+ Selen là chất bán dẫn, màu nâu đỏ. Selen dẫn điện kém trong bóng tối, dẫn điện tốt khi được chiếu sáng.
+ Telu là chất rắn, màu xám, thuộc loại nguyên tố hiếm
+ Poloni là nguyên tố kim loại, có tính phóng xạ
II. CẤU TẠO NGUYÊN TỬ CỦA NHỮNG NGUYÊN TỐ TRONG NHÓM OXI
1. Giống nhau
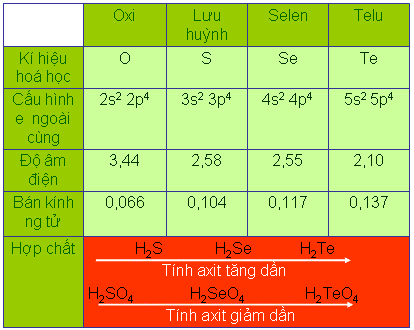
– Cấu hình electron lớp ngoài cùng: ns2np4
=> Các nguyên tố trong nhóm oxi có 6 electron lớp ngoài cùng, ở trạng thái cơ bản có 2e độc thân.
– Có khuynh hướng nhận thêm 2e để đạt cấu hình bền giống khí hiếm => Thể hiện tính oxi hoá, có số oxi hoá -2
2. Sự khác nhau giữa oxi và các nguyên tố trong nhóm
– Nguyên tố oxi không có phân lớp d; nguyên tử của các nguyên tố còn lại có phân lớp d còn trống.
– Ở trạng thái cơ bản, oxi và các nguyên tố còn lại có 2 electron độc thân
– Ở trạng thái kích thích, S, Se, Te có thể có 4, 6 electron độc thân (do có phân lớp d còn trống)
– Trong hợp chất:
+ Oxi có số oxi hoá -2 (trừ hợp chất với flo, hợp chất peoxit): do độ âm điện lớn chỉ kém flo và chỉ có 2e độc thân.
+ Các nguyên tố S, Se, Te có thể có các số oxi hoá là -2, +4, +6
III. TÍNH CHẤT CỦA CÁC NGUYÊN TỐ TRONG NHÓM OXI
1. Tính chất của đơn chất
– So với các nguyên tố khác ở cùng chu kì:
+ Độ âm điện của các nguyên tố trong nhóm oxi (trừ Poloni) chỉ kém các nguyên tố halogen.
+ Bán kính nguyên tử của các nguyên tố (trừ Poloni) chỉ lớn hơn các nguyên tố halogen
=> Các nguyên tố trong nhóm oxi là các phi kim mạnh (trừ nguyên tố Poloni), có tính oxi hoá mạnh (chỉ yếu hơn các nguyên tố halogen ở cũng chu kì)
– Tính phi kim giảm dần từ oxi đến telu
2. Tính chất của hợp chất
- Công thức phân tử các hợp chất của các nguyên tố nhóm oxi với hiđro
H2O H2S H2Se H2Te
H2SO4 H2SeO4 H2TeO4
- Qui luật biến đổi các hợp chất với hiđro của các nguyên tố nhóm oxi
H2S H2Se H2Te→
Tính axit tăng dần
- Qui luật biến đổi tính axit của các nguyên tố nhóm oxi
H2SO4 H2SeO4 H2TeO4→
Tính axit giảm dần
Giải thích: Từ S đến Te: bán kính nguyên tử tăng dần => khoảng cách từ tâm nguyên tử của các nguyên tử đến tâm nguyên tử H tăng => độ bền liên kết H-R giảm => H càng dễ bị tách ra => tính axit tăng dần
TÓM TẮT CẤU TẠO NGUYÊN TỬ VÀ TÍNH CHẤT CỦA CÁC NGUYÊN TỐ TRONG NHÓM OXI