I. SỰ HÌNH THÀNH ION, CATION VÀ ANION
1. Ion, cation và anion
a) Ion
Khi nguyên tử trung hòa về điện (số p mang điện dương bằng số e mang điện âm) nhường e hay nhận e để trở thành phần tử mang điện gọi là ion.
b) Sự tạo thành cation
Ví dụ: Sự hình thành cation của nguyên tử Li (Z = 3)
Cấu hình e: 1s22s1 dễ cho 1e để tạo thành cấu hình bền của He
1s22s1 → 1s2 + 1e
hay: Li → Li+ + 1e
Trong các phản ứng hóa học, để đạt được cấu hình bền của khí hiếm, nguyên tử kim loại có khuynh hướng nhường electron cho nguyên tử các nguyên tố khác để trở thành phần tử mang điện dương gọi là cation.
c) Sự tạo thành anion
Ví dụ: Sự hình thành anion của nguyên tử F (Z = 9)
Cấu hình e: 1s22s22p5 dễ nhận 1e để tạo thành cấu hình bền của Ne
1s22s22p5 + 1e → 1s22s22p6
hay: F + 1e → F-
Trong các phản ứng hóa học, để đạt được cấu hình bền của khí hiếm, nguyên tử phi kim có khuynh hướng nhận thêm e của nguyên tử các nguyên tố khác để trở thành phần tử mang điện âm gọi là anion.
* Quy tắc bát tử: các nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình bền bững của khí hiếm với 8 electron (hoặc của Heli với 2 electron) ở lớp ngoài cùng.
2. Ion đơn nguyên tử và ion đa nguyên tử
- Ion đơn nguyên tử là ion tạo nên từ 1 nguyên tử.
VD: Li+, Na+, Mg2+, F-, Cl-, S2-, …
- Ion đa nguyên tử là những nhóm nguyên tử mang điện tích dương hay âm
VD: NH4+, OH-, SO42-,…
II. SỰ TẠO THÀNH LIÊN KẾT ION
Định nghĩa: Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu
Xét quá trình hình thành phân tử NaCl:
Na → Na+ + 1e
Cl + 1e → Cl-
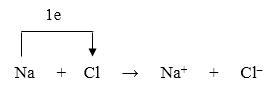
Hai ion tạo thành Na+ và Cl- mang điện tích ngược dấu hút nhau bằng lực hút tĩnh điện, tạo nên phân tử NaCl
Na+ + Cl- → NaCl

