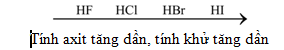* Sự biến đổi tính chất vật lí của các đơn chất
Đi từ flo đến iot:
– Trạng thái tập hợp : Từ thể khí chuyển sang thể lỏng và thể rắn.
– Màu sắc : Đậm dần.
– Nhiệt độ nóng chảy và nhiệt độ sôi: Tăng dần.
- Bán kính nguyên tử tăng dần
* Sự biến đổi độ âm điện và tính chất hoá học của các đơn chất
– Đi từ flo đến iot độ âm điện giảm dần.
– Flo có độ âm điện lớn nhất nên trong tất cả các hợp chất chỉ có số oxi hoá –1. Các nguyên tố halogen khác, ngoài số oxi hoá –1 còn có các số oxi hoá +1, +3, +5, +7.
- Đi từ flo đến iot, tính oxi hoá giảm dần.
I. ĐƠN CHẤT HALOGEN
|
|
Flo |
Clo |
Brom |
Iot |
|
Tính chất |
- Khí lục nhạt, rất độc - Là phi kim mạnh nhất - Tính oxi hóa rất mạnh: H2+ F2 −2520C→ 2HF 0F2+2H2O→2H−1F+O2 - Có trong khoáng vật: florit (CaF2) và criolit (Na3AlF6 hay AlF3.3NaF)
|
- Khí vàng lục, mùi xốc, rất độc - Là phi kim rất hoạt động, có tính oxi hóa mạnh - Tác dụng với kim loại : 20Fe+30Cl2→2+3Fe−1Cl3 - Tác dụng với hiđro: H2+0Cl2→2H−1Cl - Tác dụng với nước, dung dịch kiềm 0Cl2+H2O⇄ \mathop {C{l_2}}\limits^0 + 2NaOH \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} Na\mathop {Cl}\limits^{ - 1} + Na\mathop {Cl}\limits^{ + 1} O + {H_2}O - Tác dụng với muối của halogen yếu hơn: \begin{array}{l}\mathop {C{l_2}}\limits^0 + 2NaI \to 2Na\mathop {Cl}\limits^{ - 1} + {I_2}\\\mathop {C{l_2}}\limits^0 + 2NaBr \to 2Na\mathop {Cl}\limits^{ - 1} + B{r_2}\end{array} - Tác dụng với chất khử khác: \mathop {C{l_2}}\limits^0 + 2{H_2}O + \mathop {{\rm{ }}S}\limits^{ + 4} {O_2} \to 2H\mathop {Cl}\limits^{ - 1} {\rm{\;}} + {H_2}\mathop S\limits^{ + 6} {O_4} \mathop {C{l_2}}\limits^0 + 2FeC{l_2} \to \mathop {2Fe}\limits^{} \mathop {C{l_3}}\limits^{ - 1}
|
- Lỏng, đỏ nâu, dễ bay hơi, rất độc - Rơi vào da gây bỏng nặng - Tính oxi hóa mạnh: \mathop {{H_2}}\limits^0 + \mathop {B{r_2}}\limits^0 \to 2H\mathop {Br}\limits^{ - 1} {\rm{ }} \mathop {B{r_2}}\limits^0 + 2NaI \to 2Na\mathop {Br}\limits^{ - 1} {\rm{\;}} + {I_2} \mathop {B{r_2}}\limits^0 + {H_2}O{\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} H\mathop {Br}\limits^{ + 1} {\rm{\;}} + H\mathop {Br}\limits^{ - 1} O - Tính khử: B{r_2} + 6{H_2}O + 5C{l_2} \to 2HBr{O_3} + 10HCl
|
- Dễ thăng hoa - Iot + hồ tinh bột → màu xanh đen - Tính oxi hóa yếu hơn - Tác dụng với một số kim loại và Hiđro: 2\overset{0}{\mathop{Al}}\,+3\overset{0}{\mathop{{{I}_{2}}}}\,\xrightarrow{{{t}^{0}}}2Al\overset{-1}{\mathop{{{I}_{3}}}}\, {H_2} + \mathop {{I_2}}\limits^0 \to 2H\mathop I\limits^{ - 1} {\rm{ }}
|
|
Điều chế |
|
- Trong phòng thí nghiệm: Nguyên tắc: oxi hóa ion Cl- thành Cl2 Phương pháp: HCl đặc + chất OXH mạnh 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O KClO3 + 6HCl → KCl + 3Cl2↑ +3H2O - Trong công nghiệp: Phương pháp điện phân: 2NaCl+2H2O
|
Dùng Clo oxi hóa ion Br- C{l_2} + 2NaBr \to 2Na\mathop {Cl}\limits^{} {\rm{\;}} + B{r_2}
|
Oxi hóa I- thành I2: C{l_2} + 2NaI \to 2Na\mathop {Cl}\limits^{} {\rm{\;}} + {I_2}
|
II. HỢP CHẤT KHÔNG CÓ OXI CỦA HALOGEN
|
Tính chất |
HF |
HCl |
HBr |
HI |
|
Tính axit của dd HX |
Yếu |
Mạnh |
Mạnh hơn HCl |
Mạnh nhất |
|
Tác dụng với dd AgNO3 (nhận biết ion halogenua) |
Không, AgF là chất tan |
AgCl ↓ trắng |
AgBr↓ vàng nhạt |
AgI ↓ vàng đậm |
|
Chú ý: Tác dụng với SiO2 |
SiO2 + 4HF → SiF4 + 2H2O Axit flohiđric dùng để khắc chữ lên thủy tinh |
Không phản ứng |
||
|
Tác dụng với O2 |
Không phản ứng |
Phản ứng ở thể khí có xt 4HCl + O2\xrightarrow{xt}2H2O + Cl2 |
Dung dịch HX tác dụng với O2 của không khí 4HX + O2 → 2H2O + 2X2 |
|
|
Tác dụng với H2SO4 đặc |
Không phản ứng |
Không phản ứng |
2HBr + H2SO4 → Br2 + SO2 + 2H2O |
8HI + H2SO4 → 4I2 + H2S + 4H2O |
|
Nhận xét |
|
|||
|
Điều chế và sản xuất |
CaF2 (tinh thể) + H2SO4 (đặc) CaSO4 +2HF ↑
|
NaCl (r) + H2SO4 đặc → NaHSO4 + 2HCl(k)
|
PX3 + 3H2O → H3PO3 + 3HX
|
|
Chú ý: - HCl, HBr, HI tác dụng với kim loại tạo muối và khí H2 : 2xHX + M → MClx + xH2 \uparrow .
- HCl, HBr, HI không tác dụng được với Cu, Ag, Au, Pt.
- HCl, HBr, HI khi tác dụng với Fe và Cr chỉ tạo thành Fe2+ và Cr2+.
III. HỢP CHẤT CÓ OXI CỦA CLO
1. Nước Giaven:
Tính oxi hóa mạnh:
\mathop {C{l_2}}\limits^0 + 2NaOH \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} Na\mathop {Cl}\limits^{ + 1} {\rm{\;}} + Na\mathop {Cl}\limits^{ - 1} O + {H_2}O
(nước Gia-ven)
NaClO + CO2 + H2O → NaHCO3 + HClO
Nước Gia-ven dùng để tẩy trắng, sát trùng, tẩy
2. Clorua vôi: CaOCl2
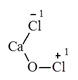
- Clorua vôi có tính oxi hóa rất mạnh:
CaOCl2 + HCl → CaCl2 +Cl2 +H2O
→ Dùng để tẩy trắng sợi, vải, tẩy uế…
3. Muối clorat
- Là muối của axit cloric (HClO3): KClO3, NaClO3,…
- Bị phân hủy bởi nhiệt: 2 KClO3 \xrightarrow{>{{500}^{0}}C} 2KCl + O2
Chú ý: P +KClO3: bốc cháy
KClO3 + S + C : nổ khi đập mạnh
- Điều chế: 3Cl2 +6KOH \xrightarrow{70-{{75}^{0}}C} 5 KCl +KClO3 +3H2O
- Ứng dụng:
+ Sản xuất hỗn hợp dễ cháy: pháo hoa, ngòi nổ,…
+ Sản xuất diêm