Chúng tôi giới thiệu Giải sách bài tập Hóa học lớp 11 Bài 33: Luyện tập: Ankin chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 11. Mời các bạn đón xem:
Giải SBT Hóa học 11 Bài 33: Luyện tập: Ankin
Bài 33.1 trang 51 SBT Hóa học 11: 1. Công thức phân tử nào cho dưới đây phù hợp với penten ?
A. C5H8 B. C5H10 C. C5H12 D. C3H6
2. Hợp chất nào dưới đây là ankin ?
A. C2H2 B. C8H8 C. C4H4 D. C6H6
3. Gốc nào dưới đây là ankyl ?
A. -C3H5 B. -C6H5 C. -C2H3 D. -C2H5
Lời giải:
1. Công thức của penten là: C5H10 Chọn B.
2. Hợp chất là ankin: C2H2 Chọn A.
3. Gốc ankyl là: -C2H5 Chọn D
Bài 33.2 trang 51 SBT Hóa học 11: 1. Trong 4 chất sau, chất có nhiệt độ sôi cao nhất ?
A. eten. B. propen.
C. but-1-en. D. pent-1-en.
2. Chất nào dưới đây không tác dụng với dung dịch AgNO3 trong amoniac ?
A. But-1-in B. But-2-in
C. Propin D. Etin
3. Chất không tác dụng với Br2 (tan trong CCl4) là ?
A. but-1-in. B. but-1-en.
C. xiclobutan. D. xiclopropan.
Lời giải:
1. Chất có nhiệt độ sôi cao nhất là: pent-1-en. Chọn D.
2. Chỉ có các ank - 1 - in có phản ứng với dung dịch AgNO3 trong amoniac Chất không tác dụng với dung dịch AgNO3 trong amoniac là But – 2 – in Chọn B.
3. Xicloankan vòng 3 cạnh tham gia phản ứng cộng mở vòng với H2/(Ni, 80oC), Br2, HBr:
Xicloankan vòng 4 cạnh chỉ tham gia cộng mở vòng với H2/(Ni, 120oC).
Xicloankan có vòng 5, 6 cạnh trở lên không có phản ứng cộng mở vòng trong những điều kiện trên.
Chất không tác dụng với Br2 (tan trong CCl4) là: xiclobutan Chọn C.
Bài 33.3 trang 51 SBT Hóa học 11: Cho propin tác dụng với HCl theo hai giai đoạn liên tiếp thì sản phẩm chính thu được là:
A. CH3 – CHCl – CH2Cl
B. CH3 – CH2 – CHCl2
C. ClCH2 – CH2 – CH2Cl
D. CH3 – CCl2 – CH3
Phương pháp giải:
Áp dụng qui tắc Mac – cop –nhi – côp
Lời giải:
Phản ứng cộng HA vào anken không đối xứng tuân theo Quy tắc Mac – cop –nhi – côp: “ nguyên tử H ưu tiên cộng vào nguyên tử cacbon bậc thấp hơn ở nối kép , A ưu tiên cộng vào nguyên tử cacbon bậc cao hơn”
Chọn D.
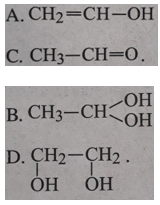
Bài 33.4 trang 51 SBT Hóa học 11: Cho axetilen phản ứng cộng với nước, xúc tác là HgSO4 và H2SO4 thì sản phẩm cuối cùng thu được là:
Lời giải:
![]()
Chọn C.
Bài 33.5 trang 51 SBT Hóa học 11: Viết phương trình hoá học của các phản ứng xảy ra trong quá trình điều chế PVC xuất phát từ các chất vô cơ : CaO, HCl, H2O, C.
Phương pháp giải:
Gợi ý: Sơ đồ điều chế như sau: CaO → CaC2 → C2H2 → CH2 = CH– Cl → PVC
Lời giải:
Bài 33.6* trang 52 SBT Hóa học 11: Hỗn hợp khí A chứa metan, axetilen và propen. Đốt cháy hoàn toàn 11 g hỗn hợp A, thu được 12,6 g H2O. Mặt khác, nếu dẫn 11,2 lít A (đktc) qua nước brom (lấy dư) thì khối lượng brom nguyên chất phản ứng tối đa là 100 g.
Hãy xác định thành phần phần trăm theo khối lượng và theo thể tích của từng chất trong hỗn hợp A.
Phương pháp giải:
+) Giả sử trong 11 gam hỗn hợp A có x mol CH4, y mol C2H2 và z mol C3H6
+) Viết các PTHH:
CH4 + 2O2 CO2 + 2H2O
2C2H2 + 5O2 4CO2 + 2H2O
2C3H6 + 9O2 6CO2 + 6H2O
C2H2 + 2Br2 C2H2Br4
C3H6 + Br2 C3H6Br2
+) Khai thác dữ kiện đề bài lập hệ pt x, y, z.
Tính thành phần phần trăm theo khối lượng và theo thể tích của từng chất trong A.
Lời giải:
Giả sử trong 11 gam hỗn hợp A có x mol CH4, y mol C2H2 và z mol C3H6 :
16x + 26y + 42z = 11 (1)
Khi đốt cháy 11 g A :
CH4 + 2O2 CO2 + 2H2O
x mol 2x mol
2C2H2 + 5O2 4CO2 + 2H2O
y mol y mol
2C3H6 + 9O2 6CO2 + 6H2O
z mol 3z mol
Số mol H2O:
2x + y + 3z = = 0,7 (mol) (2)
Số mol A được dẫn qua nước brom là : = 0,5 (mol).
Số mol đã dự phản ứng : = 0,625 (mol).
Nếu dẫn 11 g A đi qua nước brom :
CH4 không phản ứng
x mol
C2H2 + 2Br2 C2H2Br4
y mol 2y mol
C3H6 + Br2 C3H6Br2
z mol z mol
Như vậy : (x + y + z) mol A tác dụng với (2y + z) mol Br2,
0,500 mol A tác dụng với 0,625 mol Br2
5x + z = 3y
Giải hệ phương trình, tìm được x = 0,1 ; y = 0,2 ; z = 0,1
Thành phần phần trăm các chất trong hỗn hợp A :
|
|
Theo khối lượng |
Theo thể tích |
|
|
|
|
|
|
|
|
|
|
|
|
Bài 33.7* trang 52 SBT Hóa học 11: Một bình kín dung tích 8,4 lít có chứa 4,96 g O2 và 1,3 gam hỗn hợp khí A gồm 2 hiđrocacbon. Nhiệt độ trong bình = 0°C và áp suất trong bình = 0,5 atm.
Bật tia lửa điện trong bình kín đó thì hỗn hợp A cháy hoàn toàn. Sau phản ứng, nhiệt độ trong bình là t2 = 136,5°C và áp suất là atm. Dẫn các chất trong bình sau phản ứng đi qua bình thứ nhất đựng H2SO4 đặc, sau đó qua bình 2 đựng dung dịch NaOH (có dư) thì khối lượng bình thứ hai tăng 4,18 g.
1. Tính p2, biết rằng thể tích bình không đổi.
2. Xác định công thức phân tử và phần trăm theo thể tích của từng chất trong hỗn hợp A nếu biết thêm rằng trong hỗn hợp đó có một chất là anken và một chất là ankin.
Phương pháp giải:
1. Áp dụng công thức:
2. +) Đặt lượng CnH2n là a mol, lượng CmH2m-2 là b mol
+) Viết PTHH:
+) Khai thác dữ kiện đề bài lập hệ pt, biện luận để tìm n, m.
=> Tính phần trăm theo thể tích của từng chất trong hỗn hợp A
Lời giải:
1.
Số mol CO2 là : = 0,095 (mol).
Khối lượng C trong hỗn hợp A là : 0,095.12 = 1,14 (g).
Khối lượng H trong hỗn hợp A là : 1,3 - 1,14 = 0,16 (g).
Số mol H2O sau phản ứng là : = 0,08 (mol).
Để tạo ra 0,095 mol CO2 cần 0,095 mol O2 ;
Để tạo ra 0,08 mol H2O cần = 0,04 (mol) O2.
Số mol O2 đã tham gia phản ứng là : 0,095 + 0,04 = 0,135 (mol).
Số mol O2 ban đầu là : =0,155 (mol).
Số mol O2 còn dư là : 0,155 - 0,135 = 0,02 (mol).
Số mol 3 chất trong bình sau phản ứng :
0,095 + 0,08 + 0,02 = 0,195 (mol).
Nếu ở đktc thì Vo = 0,195.22,4 = 4,37 (lít).
Thực tế = 8,4 lít
2. Đổi thể tích hỗn hợp khí trước phản ứng về đktc :
Số mol khí trước phản ứng : = 0,1875 (mol).
Số mol 2 hiđrocacbon : 0,1875 - 0,155 = 0,0325 (mol).
Đặt lượng CnH2n là a mol, lượng CmH2m-2 là b mol, ta có a + b = 0,0325.
a 1,5na na
b (1,5m-0,5)b mb
Số mol O2 : 1,5na + (1,5m - 0,5)b = 0,135 (2)
Số mol CO2 : na + mb = 0,095 (3)
Từ (2) và (3), tìm được b = 0,015 a = 0,0175
Thay các giá trị của a và b vào (3), ta có :
7n + 6m = 38
Nếu n = 2 thì m = = 4 ;
Nếu n = 3 thì m = = 2,83 (loại) ;
Nếu n > 3 thì m < 2 (loại).
% về thể tích của C2H4 : . 100% = 53,8%.
% về thể tích của C4H6 là 46,2%
Bài 33.8 trang 52 SBT Hóa học 11: Trình bày phương pháp hoá học để phân biệt các hiđrocacbon sau :
1. axetilen và metan ;
2. axetilen và etilen ;
3. axetilen, etilen và metan ;
4. but-1-in và but-2-in.
Lời giải:
1. Dùng phản ứng với nước brom.
2. Dùng phản ứng với dung dịch AgN03 trong amoniac.
3. Dùng phản ứng với dung dịch AgN03 trong amoniac sau đó dùng phản ứng với nước brom.
4. Dùng phản ứng với dung dịch AgN03 trong amoniac.
Bài 33.9 trang 52 SBT Hóa học 11: Cho biết phương pháp làm sạch chất khí:
1. metan lẫn tạp chất là axetilen và etilen ;
2. etilen lẫn tạp chất là axetilen.
Phương pháp giải:
Gợi ý:
1. Dùng nước brom và H2SO4 đặc
2. Dùng AgNO3 trong amoniac và H2SO4 đặc
Lời giải:
1. Dẫn hỗn hợp khí đi qua nước brom (lấy dư). Sau đó dẫn metan đi qua H2SO4 đặc để làm khô.
2. Dẫn hỗn hợp khí đi qua lượng dư dung dịch AgNO3 trong amoniac. Sau đó dẫn etilen đi qua H2SO4 đặc để làm khô.