Chúng tôi giới thiệu Giải bài tập Hóa Học lớp 11 Bài 19: Luyện tập: Tính chất của cacbon, silic và các hợp chất của chúng chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Luyện tập: Tính chất của cacbon, silic và các hợp chất của chúng lớp 11.
Giải bài tập Hóa Học lớp 11 Bài 19: Luyện tập: Tính chất của cacbon, silic và các hợp chất của chúng
Câu hỏi và bài tập (trang 86 sgk Hóa học 11)
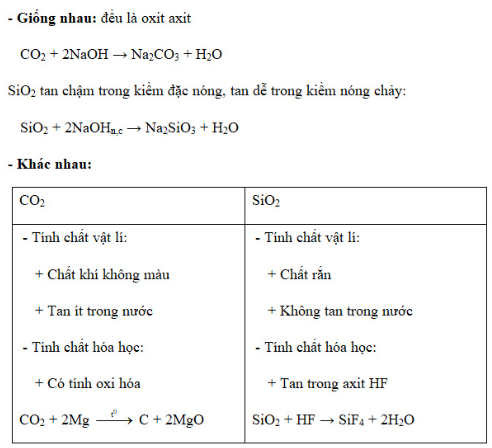
Bài 1 trang 86 sgk hóa học 11: Nêu các điểm giống và khác nhau về tính chất giữa cacbon đioxit và silic đioxit ?
- Giống nhau: đều là oxit axit
Lấy ví dụ cả 2 chất đều tác dụng được với NaOH
- Khác nhau: Kẻ bảng so sánh sự khác nhau về tính chất vật lí và tính chất hóa học
Lấy ví dụ minh họa
Lời giải:
Bài 2 trang 86 sgk hóa học 11: Phản ứng hóa học không xảy ra ở những cặp chất nào sau đây ?
a) C và CO b)CO2 và NaOH
c) K2CO3 và SiO2 d) H2CO3 và Na2SiO3
e) CO và CaO g) CO2 và Mg
h) SiO2 và HCl i) Si và NaOH
Phản ứng hóa học không xảy ra khi cả 2 chất đều có tính hóa học tương tự nhau;hoặc phản ứng không sinh ra chất kết tủa, chất bay hơi
Ví du: cùng có tính khử, cùng có tính oxi hóa mạnh sẽ không phản ứng được với nhau
Không có phản ứng hóa học xảy ra ở các trường hợp sau: a, c, e, h
a) C và CO cùng có tính khử nên không phản ứng với nhau
b) CO2 + NaOH → NaHCO3
Hoặc CO2 + 2NaOH → Na2CO3 + H2O
c) K2CO3 và SiO2 không phản ứng được với nhau vì SiO2 không có tính chất tác dụng với muối
d) H2CO3 + Na2SiO3 → Na2CO3 + H2SiO3↓
e) Không phản ứng
g) CO2 + 2Mg 2MgO + C
h) Không phản ứng
i) Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
Bài 3 trang 86 sgk hóa học 11: Có các chất sau: CO2, Na2CO3, C, NaOH, Na2SiO3, H2SiO3. Hãy lập thành một dãy chuyển hóa giữa các chất và viết phương trình hóa học.
Dãy chuyển hóa giữa các chất:
C → CO2 Na2 CO3 NaOH Na2SiO3 H2SiO3
Các phương trình phản ứng:
C + O2 CO2
CO2 + 2NaOH → Na2 CO3↓ + H2O
Na2 CO3 + Ba(OH)2 → BaCO3 ↓ + 2NaOH
SiO2 + 2NaOHđặc, nóng → Na2SiO3 + H2O
Na2SiO3 + 2HCl → H2SiO3 ↓ + 2NaCl
Bài 4 trang 86 sgk hóa học 11: Cho 5,94 g hỗn hợp K2CO3 và Na2CO3 tác dụng với dung dịch H2SO4 dư thu được 7,74 g hỗn hợp các muối khan K2SO4 và Na2SO4. Thành phần hỗn hợp đầu là:
A. 3,18 g Na2CO3 và 2,76 g K2CO3
B. 3,81 g Na2CO3 và 2,67 g K2CO3
C. 3,02 g Na2CO3 và 2,25 g K2CO3
D. 4,27 g Na2CO3 và 3,82 g K2CO3
Gọi x và y lần lượt là số mol của K2CO3 và Na2CO3
K2CO3 + H2SO4 → K2SO4 + H2O + CO2↑
x → x (mol)
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
y → y (mol)
Giải hệ phương trình:
=> mK2CO3 và mNa2CO3 =?
Gọi x và y lần lượt là số mol của K2CO3 và Na2CO3
K2CO3 + H2SO4 → K2SO4 + H2O + CO2↑
x → x (mol)
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
y → y (mol)
Giải hệ phương trình:
Đáp án A
Gọi x và y lần lượt là số mol của CO và
Viết PTHH:
2CO + O2 2CO2 (1)
x mol mol x mol
2H2 + O2 2H2O (2)
y mol mol y mol
Số mol oxi: = 0,400 (mol)
Theo đầu bài ta có:
Tính ra: x = ?; y= ?
Từ đó tính được thành phần phần trăm theo thể tích và theo số mol
Lời giải:
PTHH : 2CO + O2 2CO2 (1)
x mol mol x mol
2H2 + O2 2H2O (2)
y mol mol y mol
Số mol oxi: = 0,400 (mol)
Theo đầu bài ta có:
Tính ra: x = 0,200; y= 0,600
Phần trăm thể tích bằng phần trăm số mol: 75,0% H2 và 25,0%CO
Phần trăm khối lượng khí hidro: x 100% = 17,6%
Phần trăm khối lượng khí CO là 82,4%
Bài 6 trang 86 sgk hóa học 11: Một loại thủy tinh có thành phần hóa học được biểu diễn bằng công thức K2O.PbO.6SiO2. Tính khối lượng K2CO3, PbCO3 và SiO2 cần dùng để có thể sản xuất được 6,77 tấn thủy tinh trên. Coi hiệu suất qua trình là 100%.
Tính số mol của thủy tinh n = m : MK2O.PbO.6SiO2 =?
Từ đó tính được số mol của K2CO3, PbCO3 và SiO2 cần dùng
Lời giải:
Khối lượng 1 mol phân tử thủy tinh K2O.PbO.6SiO2 là 677g
= x 138 = 1,38 (tấn)
= x 267 = 2,67 (tấn)
= x 6 x 60,0 = 3,6 (tấn)
Để nấu được 6,77 tấn thủy tinh trên cần dùng 13,8 tấn K2CO3, 2,67 tấn PbCO3 và 3,6 tấn SiO2
Lý thuyết luyện tập tính chất của cacbon, silic và các hợp chất của chúng1.Cacbon
- Cacbon chủ yếu thể hiện tính khử: + 2CuO 2Cu +
- Cacbon thể hiện tính oxi hóa: 3 + 4Al
2.Oxit ( CO, CO2)
a) CO:
- Là oxit trung tính (không tạo muối)
- Có tính khử mạnh: 4 + Fe3O4 3Fe + 4
b) CO2 :
- Là oxit axit
- Có tính oxi hóa: + 2Mg + 2MgO
3. H2CO3
- H2CO3 không bền, phân hủy thành CO2 và H2O
- H2CO3 là axit yếu, trong dung dịch phân li hai nấc
4. Muối cacbonat
- Muối cacbonat của kim loại kiềm dễ tan trong nước và bền với nhiệt. Các muối cacbonat khác ít tan và dễ bị nhiệt phân:
CaCO3 CaO + CO2
- Muối hidrocacbonat dễ tan và ít bị nhiệt phân:
Ca(HCO3)2 CaCO3 + CO2 + H2O
5. Silic
- Silic thể hiện tính khử : Si + 2F2 SiF4
- Silic thể hiện tính oxi hóa: Si + 2Mg → Mg2Si
6. SiO2
- Tan được trong kiềm nóng chảy: SiO2 + 2NaOH → Na2SiO3 + H2O
- Tác dụng với dung dịch axit HF: SiO2 + 4HF → SiF4↑ + 2 H2O
7. Axit silixic
- H2SiO3 là axit ở dạng rắn, ít tan trong nước.
- H2SiO3 là axit rất yếu, yếu hơn cả axit cacbonic
8. Muối silicat
- Muối silicat của kim loại kiềm dễ tan trong nước.
- Dung dịch đậm đặc của Na2SiO3, K2SiO3 được gọi là thủy tinh lỏng, dùng để sản xuất xi măng chịu axit, chất kết dính trong xây dựng….

