Chúng tôi giới thiệu Giải bài tập Hóa Học lớp 11 Bài 16: Hợp chất của cacbon chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Hợp chất của cacbon lớp 11.
Giải bài tập Hóa Học lớp 11 Bài 16: Hợp chất của cacbon
Câu hỏi và bài tập (trang 75 sgk Hóa học 11)
Bài 1 trang 75 sgk hóa học 11: Làm thế nào để loại hơi nước và khí CO2 có lẫn trong khí CO ? Viết các phương trình hóa học?
Lời giải:
- Dẫn hỗn hợp khí đi qua dung dịch nước vôi trong dư, khí cacbonic sẽ bị giữ lại
CO2 + Ca(OH)2 → CaCO3 + H2O
- Còn lại hơi nước và CO ta dẫn qua bình H2SO4 đặc thì hơi nước bị giữ lại, ta thu được khí CO
Bài 2 trang 75 sgk hóa học 11:Có ba chất gồm CO, HCl và SO2 đựng trong ba bình riêng biệt. Trình bày phương pháp hóa học để nhận biết từng chất khí. Viết các phương trình hóa học.
SO2 là oxit axit, có tính khử
HCl là axit
CO là oxit trung tính
=> Dựa vào tính chất hóa học khác nhau của các chất để chọn chỉ thị phân biệt chúng.
- Cách 1:
Dẫn 3 khí qua dung dịch nước Br2. Khí nào làm mất màu dd nước Br2 là SO2.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
2 khí còn lại không làm mất màu là HCl và CO. Cho quỳ tím ẩm vào 2 khí này, khí nào làm quỳ tím chuyển sang màu đỏ là HCl, còn lại không có hiện tượng gì là CO
- Cách 2:
+ Để cánh hoa hồng lên miệng từng ống nghiệm, ống nào làm nhạt cánh hoa hồng là SO2
+ Dẫn hai khí còn lại qua dung dịch AgNO3 nếu thấy xuất hiện kết tủa màu trắng là khí HCl, nếu không thấy xuất hiện hiện tượng gì là CO
HCl + AgNO3 AgCl + HNO3
Bài 3 trang 75 sgk hóa học 11: Điều nào sau đây không đúng cho phản ứng của khí CO và O2?
A. Phản ứng thu nhiệt.
B. Phản ứng tỏa nhiệt.
C. Phản ứng kèm theo sự giảm thể tích.
D. Phản ứng không xảy ra ở điều kiện thường
A. Sai vì đây là phản ứng tỏa nhiệt
B. Đúng
C. Đúng vì theo chiều thuận: cứ 2 mol CO kết hợp với 1 mol O2 sinh ra 2 mol CO2 => giảm 1 mol khí => giảm thể tích
D. Đúng vì ban đầu để phản ứng xảy ra phải cần đun nóng
Bài 4 trang 75 sgk hóa học 11: a) Khi đun nóng dung dịch canxi hidrocacbonat thì có kết tủa xuất hiện. Tổng các hệ số tỉ lượng trong phương trình hóa học của phản ứng là:
A. 4 B. 5 C. 6 D. 7
b) Khi cho dư khí CO2 vào dung dịch chứa kết tủa caxi cacbonat, thì kết tủa sẽ tan. Tổng các hệ số tỉ lượng trong phương trình hóa học của phản ứng là:
A. 4 B. 5 C. 6 D. 7
Lời giải:
a) Ca (HCO3)2 CaCO3 + CO2 + H2O.
=> tổng hệ số = 1+1+1+1 = 4
Đáp án A
b) CaCO3 + CO2 + H2O → Ca (HCO3)2
=> tổng hệ số = 1+1+1+1 = 4
Đáp án A
Bài 5 trang 75 sgk hóa học 11: Cho 224,0 ml CO2 (dktc) hấp thụ hết trong 100,0ml dung dịch kali hidroxit 0,200 M. Tính khối lượng của những chất có trong dung dịch tạo thành.
= = a (mol); nKOH = 0,1 x 0,2 = b (mol)
= = k
Nếu k ≤1 => chỉ tạo muối KHCO3
Nếu 1 < k tạo cả 2 muối KHCO3 và K2CO3
Nếu k ≥ 2 => chỉ tạo muối K2CO3
Lời giải:
= = 0,01 (mol); nKOH = 0,1 x 0,2 = 0,02 (mol)
= = 2 => chỉ tạo muối K2CO3
2 KOH + CO2 → K2CO3 + H2O
0,02 → 0,01→ 0,01 (mol)
Trong dung dịch sau phản ứng chỉ có K2CO3:
= 0,01. 138 = 1,38 (g)
Bài 6 trang 75 sgk hóa học 11: Nung 52,65 g CaCO3 ở 1000C và cho toàn bộ lượng khí thoát ra hấp thụ hết vào 500,0 ml dung dịch NaOH 1,800M. Hỏi thu được những muối nào? Muối khối lượng là bao nhiêu? Biết rằng hiệu suất phản ứng nhiệt phân CaCO3 là 95%.
CaCO3 CaO+CO2
= = 52,65/100 = 0,5265 (mol)
Vì phản ứng trên có h = 95 % nên thực tế thu được:
= 0,5265 * 95/100 = 0,5 mol
Ta có nNaOH = 0,5 x 1,8 = 0,9(mol)
Tỉ lệ số mol giữa NaOH và CO2 : 1 < = < 2
Do đó, phản ứng tạo thành hỗn hợp hai muối: NaHCO3 và Na2CO3
NaOH + CO2 → NaHCO3
x → x (mol)
2NaOH + CO2 → Na2CO3 + H2O
2y → y (mol)
Ta có hệ phương trình:
Khối lượng NaHCO3 = 84x =? (g)
Khối lượng của Na2CO3 = 106y = ? (g)
Lời giải:
CaCO3 CaO+CO2
= = 52,65/100 = 0,5265 (mol)
Vì phản ứng trên có h = 95 % nên thực tế thu được:
= 0,5265 * 95/100 = 0,5 mol
Ta có nNaOH = 0,5 x 1,8 = 0,9(mol)
Tỉ lệ số mol giữa NaOH và CO2 : 1 < = < 2
Do đó, phản ứng tạo thành hỗn hợp hai muối: NaHCO3 và Na2CO3
NaOH + CO2 → NaHCO3
x → x (mol)
2NaOH + CO2 → Na2CO3 + H2O
2y → y (mol)
Ta có hệ phương trình:
Khối lượng NaHCO3 = 0,1. 84 =8,4 (g)
Khối lượng của Na2CO3 = 0,4.106 = 42,4(g)
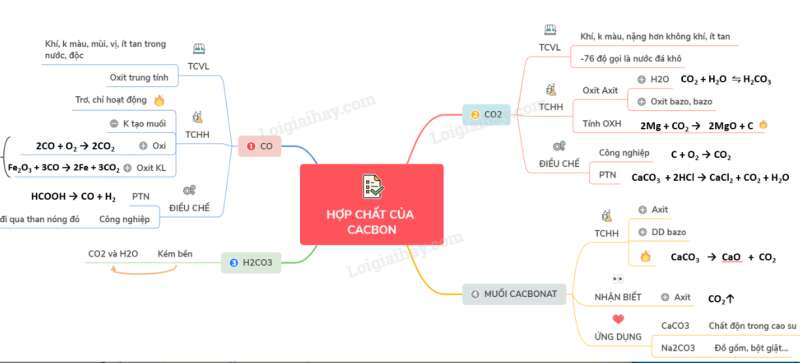
Lý thuyết hợp chất của cacbon
1. CO là chất khí không màu
A. CACBON MONOXIT
I. TÍNH CHẤT VẬT LÍ
- CO là chất khí không màu, không mùi, không vị, ít tan trong nước, bền với nhiệt và rất độc.
- Kém hoạt động ở nhiệt độ thường, hoạt động nhiều hơn khi đun nóng
- CO là oxit trung tính
II. TÍNH CHẤT HÓA HỌC
- Phân tử CO có liên kết ba bền vững nên ở nhiệt độ thường C rất trơ, chỉ hoạt động trong điều kiện nhiệt độ cao.
- CO là oxit trung tính không có khả năng tạo muối → không tác dụng với dung dịch bazơ và dung dịch axit ở nhiệt độ thường.
1. Tính khử mạnh
- Tác dụng với oxi: cho ngọn lửa màu lam nhạt
2CO + O2 2CO2
- Tác dụng với oxit kim loại:
Fe2O3 + 3CO 2Fe + 3CO2
2. Cacbon monoxit là oxit không tạo muối
III. ĐIỀU CHẾ
1. Trong phòng TN
HCOOH CO + H2
2. Trong công nghiệp
Cho hơi nước đi qua than nóng đỏ thu được khí than ướt
B. CACBON ĐIOXIT
I. TÍNH CHẤT VẬT LÍ
- CO2 là chất khí, không màu nặng hơn không khí, ít tan trong nước.
- Làm lạnh đột ngột ở -76oC, khí CO2 hóa thành khối rắn gọi là “nước đá khô”.
- Nước đá khô không nóng chảy mà thăng hoa.
II. TÍNH CHẤT HÓA HỌC
1. Tính chất của oxit axit
- Tác dụng với nước tạo thành dung dịch axit yếu.
CO2 (k) + H2O (l) ⇋ H2CO3 (dd)
- Tác dụng với oxit bazơ, bazơ tạo thành muối.
CO2 + NaOH → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
CaO + CO2 → CaCO3 (tº)
2. Tính OXH (Khi tác dụng với chất có tính khử mạnh)
2Mg + CO2 2MgO + C
III. ĐIỀU CHẾ
1. Trong công nghiệp
C + O2 → CO2 (đốt cháy hoàn toàn than cốc trong không khí)
CaCO3 → CaO + CO2 (1000ºC)
2. Trong phòng thí nghiệm
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
C. AXIT CACBONIC VÀ MUỐI CACBONAT
I. AXIT CACBONIC
- Là axit kém bền, chỉ tồn tại trong dung dịch loãng, dễ bị phân hủy thành CO2 và H2O.
- Là axit hai nấc, trong dung dịch phân li hai nấc.
H2CO3 ⇋ H+ + HCO3-
HCO3- ⇋ H+ + CO32-
II. MUỐI CACBONAT
- Muối cacbonat của kim loại kiềm, amoni và đa số các muối hidrocacbonat đều tan tốt trong nước
- Muối cacbonat của các kim loại còn lại không tan, muối hidrocacbonat kếm bền nên dễ bị nhiệt phân
1. Tính chất hóa học
a) Tác dụng với axit:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
NaHCO3 + HCl → NaCl + CO2 + H2O
b) Tác dụng với dung dịch bazo:
NaHCO3 + NaOH → Na2CO3 + H2O
c) Phản ứng nhiệt phân:
2NaHCO3 → Na2CO3 + CO2 + H2O
CaCO3 → CaO + CO2
2. Nhận biết
Cho tác dụng với axit → CO2
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
3. Tính chất và ứng dụng của một số muối cacbonat
- Canxi cacbonat (CaCO3) tinh khiết là chất bột nhẹ, màu trắng, dùng làm chất dộn trong cao su và 1 số ngành công nghiệp.
- Natricacbonat (Na2CO3) khan (sođa khan) là chất bột màu trắng, tan nhiều trong nước. Dùng trong công ngiệp thủy tinh, đồ gốm, bột giặt, …
Sơ đồ tư duy: Hợp chất của cacbon
Dạng 1: Lý thuyết về một số hợp chất của cacbon
* Một số ví dụ điển hình:
Ví dụ 1: Một trong những nguyên nhân gây tử vong trong nhiều vụ cháy là do nhiễm độc khí X. Khi vào cơ thể, khí X kết hợp với hemoglobin, làm giảm khả năng vận chuyển oxi của máu. Khí X là
A. NH3
B. N2
C. CO
D. H2
Hướng dẫn giải chi tiết:
Khí X là khí CO
Đáp án C
Ví dụ 2: Đá khô hay còn gọi là nước đá khô, đá khói, băng khô hay băng khói. Đá khô thường được dùng để bảo quản thực phẩm dễ hỏng, bảo quản chế phẩm sinh học, hoặc dùng làm sương mù trong các hiệu ứng đặc biệt... Vậy đá khô là dạng rắn của chất nào sau đây?
A. O2
B. H2O
C. N2
D. CO2
Hướng dẫn giải chi tiết:
CO2 ở trạng thái rắn được gọi là đá khô
Đáp án D
Ví dụ 3: Có 3 muối dạng bột NaHCO3, Na2CO3 và CaCO3. Chọn hoá chất thích hợp để nhận biết mỗi chất
A. Qùy tím
B. Phenolphtalein
C. Nước và HCl
D. Qùy tím và HCl
Hướng dẫn giải chi tiết:
hoá chất thích hợp để nhận biết mỗi chất là Nước và HCl.
|
|
NaHCO3 |
Na2CO3 |
CaCO3 |
|
Nước |
tan |
tan |
không tan |
|
Nhỏ từ từ HCl |
có khí thoát ra ngay |
khí thoát ra sau một thời gian |
|
Đáp án C
Ví dụ 4: Xét các muối cacbonat, nhận định nào dưới đây là đúng?
A. Tất cả các muối cacbonat đều tan tốt trong nước
B. Tất cả các muối cacbonat đều bị nhiệt phân tạo ra oxit kim loại và cacbon đioxit
C. Tất cả các muối cacbonat đều bị nhiệt phân, trừ muối cacbonat của kim loại kiềm
D. Tất cả các muối cacbonat đều không tan trong nước
Hướng dẫn giải chi tiết:
A sai vì các muối cacbonat như CaCO3, MgCO3, … đều không tan trong nước
B sai vì các muối cacbonat của kim loại kiềm không bị nhiệt phân
D sai vì các muối cacbonat kim loại kiềm đều tan trong nước
Đáp án C
Ví dụ 5: Cho các chất: O2 (1), NaOH (2), Mg (3), Na2CO3 (4), SiO2 (5), HCl (6), CaO (7), Al (8), ZnO (9), H2O (10), NaHCO3 (11), KMnO4 (12), HNO3 (13), Na2O (14). Cacbon đioxit phản ứng trực tiếp được với bao nhiêu chất?
A. 5
B. 6
C. 7
D. 8
Hướng dẫn giải chi tiết:
CO2 phản ứng được với: NaOH, Mg, Na2CO3, CaO, H2O, Na2O
Đáp án B
Dạng 2: CO2 tác dụng với dung dịch kiềm
* Một số lưu ý cần nhớ:
Ta có phương trình hóa học:
CO2 + OH- → HCO3-
CO2 + 2OH- → CO32- + H2O
Đặt T =
Ta có:
|
Giá trị của T |
Chất thu được sau phản ứng |
|
T = 1 |
Muối hidro cacbonat (HCO3-) |
|
T = 2 |
Muối cacbonat (CO32-) |
|
T < 1 |
Muối hidro cacbonatvà CO2 dư |
|
T > 2 |
Muối cacbonatvà dung dịch kiềm dư |
|
1 < T < 2 |
Muối hidro cacbonat và muối cacbonat |
* Một số ví dụ điển hình:
Ví dụ 1: Cho 7,84 lít khí CO2 (đktc) tác dụng với 250 ml dung dịch KOH 2M sau phản ứng, cô cạn dung dịch thu được tổng khối lượng sản phẩm rắn là:
A. 40,7 gam
B. 38,24 gam
C. 26 gam
D. 34,5 gam
Hướng dẫn giải chi tiết:
nKOH = 0,5 mol; nCO2 = 0,35 mol
Xét: nOH- / nCO2 = 0,5/0,35 = 10/7
=> Tạo 2 muối K2CO3 và KHCO3
Tuy nhiên khi cô cạn dung dịch thì muối KHCO3 bị nhiệt phân thành K2CO3
Bảo toàn K => nK2CO3 = 0,25 mol => m = 34,5g
Đáp án D
Ví dụ 2: Cho 5,6 lít CO2 (đktc) hấp thụ hoàn toàn trong dung dịch chứa 0,18 mol Ca(OH)2. Khối lượng kết tủa thu được là:
A. 18 gam
B. 11 gam
C. 14 gam
D. 16 gam
Hướng dẫn giải chi tiết:
nCO2 = 0,25 mol; nOH- = 0,36 mol
Xét tỉ lệ: nOH- / nCO2 = 0,36 / 0,25 = 1,44 => sau phản ứng thu được 2 muối
Sử dụng công thức tính nhanh: = 0,36 – 0,25 = 0,11 mol
=> nCaCO3 = nCO3 = 0,11 mol => m = 11 gam
Đáp án B
Ví dụ 3: Cho 11,2 lít CO2 (đktc) hấp thụ hết trong dung dịch chứa a mol Ca(OH)2 và 0,2 mol NaOH. Xác định giá trị của a để sau phản ứng thu được 10 gam kết tủa:
A. 0,3
B. 0,15
C. 0,2
D. 0,1
Hướng dẫn giải chi tiết:
nCO2 = 0,5 mol; nCaCO3 = 0,1 mol
TH1: thu được 1 muối CO32-
=> nCa2+ = nCaCO3 = 0,1 mol => a = 0,1
Kiểm tra lại:
nOH- = 2.nCa(OH)2 + nNaOH = 2.0,1 + 0,2 = 0,4 mol
Mà thu được muối CO32- thì nOH- 2.nCO2 => 0,4 2.0,5 (vô lí) => loại trường hợp này
TH2: thu được 2 muối HCO3- và CO32-
Sử dụng công thức tính nhanh:
=> 2a + 0,2 – 0,5 = 0,1 => a = 0,2 mol
Đáp án C
Dạng 3: Bài toán muối cacbonat tác dụng với dung dịch axit
* Một số ví dụ điển hình:
Ví dụ 1: Hòa tan hoàn toàn 20,6 gam hỗn hợp gồm Na2CO3 và CaCO3 bằng dung dịch HCl dư, thu được V lít khí CO2 (đktc) và dung dịch chứa 22,8 gam hỗn hợp muối. Giá trị của V là
A. 1,76
B. 4,48
C. 5,6
D. 2,24
Hướng dẫn giải chi tiết:
Đặt nNa2CO3 = x và nCaCO3 = y (mol)
m hh = mNa2CO3 + mCaCO3 = 106x + 100y = 20,6 (1)
BTNT “Na”: nNaCl = 2nNa2CO3 = 2x (mol)
BTNT “Ca”: nCaCl2 = nCaCO3 = y (mol)
m muối = mNaCl + mCaCl2 = 58,5.2x + 111y = 22,8 (2)
Giải (1) và (2) được x = 0,1 và y = 0,1
BTNT “C” => nCO2 = nNa2CO3 + nCaCO3 = 0,1 + 0,1 = 0,2 mol
=> V = 4,48 lít
Đáp án B
Ví dụ 2: Cho 115,3 gam hỗn hợp 2 muối MgCO3 và RCO3 vào dung dịch H2SO4 loãng, thu được 4,48 lít khí CO2 đktc, chất rắn X và dung dịch Y chứa 12 gam muối. Nung X đến khối lượng không đổi, thu được chất rắn Z và 11,2 lít khí CO2 đktc. Khối lượng của Z là
A. 92,1 gam
B. 80,9 gam
C. 84,5 gam
D. 88,5 gam
Hướng dẫn giải chi tiết:
115,3 gam RCO3 , MgCO3 thì CO32- + 2H+ → H2O + CO2
Ta có nH2SO4 = nCO2 = nH2O = 0,2 mol
Bảo toàn khối lượng có mmuối ban đầu + mH2SO4 = mmuối + mCO2 + mX + mH2O
→ 115,3 + 0,2.98 = 12 + mX + 0,2.44 + 0,2.18 → mX = 110,5 g
X → Z + 0,5 mol CO2
Bảo toàn khối lượng có mZ = mX – mCO2 = 110,5 – 0,5.44 = 88,5g
Đáp án D
Ví dụ 3: Cho từ từ đến hết 250 ml dung dịch B gồm NaHCO3 1M và Na2CO3 1M vào 120 ml dung dịch A gồm H2SO4 1M và HCl 1M, thu được V lít khí CO2 (đktc) và dung dịch X. Cho dung dịch Ba(OH)2 dư vào dung dịch X thì được m gam kết tủa. Giá trị của m và V là
A. 79,18 và 5,376
B. 53,57 và 5,376.
C. 79,18 và 3,360.
D. 53,57 và 3,360
Hướng dẫn giải chi tiết:
Dung dịch A: nH+ = 0,36 mol và nSO42- = 0,12 mol
Dung dịch B: nHCO3- = nCO32- = 0,25 mol
Vì tỉ lệ số mol của HCO3- và CO32- ban đầu bằng nhau nên ta gọi nHCO3- phản ứng = nCO32- phản ứng = x mol
=> nH+ = x + 2x = 0,36 => x = 0,12
=> nCO2 = x + x = 0,24 mol => V = 5,376 lít
Dung dịch X chứa HCO3- dư (0,13 mol), CO32- dư (0,13 mol), SO42- (0,12 mol) và các ion khác
=> mkết tủa = 79,18 gam
Đáp án A
Dạng 4: Bài toán nhiệt phân muối cacbonat
* Một số lưu ý cần nhớ:
- Hầu hết các muối cacbonat đều không tan (trừ muối của Na, K và NH4)
- Các muối hidrocacbonat đều tan
VD:
CaCO3 → CaO + CO2
NaHCO3 → Na2CO3 + CO2 + H2O
Ba(HCO3)2 → BaCO3 + CO2 + H2O
BaCO3 → BaO + CO2
* Một số ví dụ điển hình:
Ví dụ 1: Nung 100 gam hỗn hợp gồm Na2CO3 và NaHCO3 cho đến khi khối lượng hỗn hợp không đổi được 69 gam chất rắn. Phần trăm khối lượng của mỗi chất tương ứng trong hỗn hợp ban đầu là :
A. 15,4% và 84,6%.
B. 22,4% và 77,6%.
C. 16% và 84%.
D. 24% và 76%.
Hướng dẫn giải chi tiết:
Chỉ có NaHCO3 bị phân hủy. Đặt x là số gam NaHCO3
2NaHCO3 Na2CO3 + CO2 + H2O (1)
mol : x → 0,5x
Theo (1) và giả thiết ta có : 84x – 106.0,5x = 100 – 69 Þ x = 1 Þ gam.
Vậy NaHCO3 chiếm 84% và Na2CO3 chiếm 16%.
Đáp án C.
Ví dụ 2: X là 1 loại đá vôi chứa 80% CaCO3, phần còn lại là tạp chất trơ. Nung 50 gam X một thời gian, thu được 39 gam chất rắn. % CaCO3 đã bị phân huỷ là :
A. 50,5%.
B. 60%.
C. 62,5%.
D. 65%.
Hướng dẫn giải chi tiết:
Giả sử có 100 gam đá vôi thì khối lượng của CaCO3 là 80 gam. Do đó trong 50 gam X có 40 gam CaCO3.
Phương trình phản ứng hóa học :
CaCO3 CaO + CO2 (1)
mol: x → x
Theo phương trình và theo giả thiết ta có :
100x – 56x = 50 – 39 = 11 x = 0,25
Vậy % CaCO3 bị phân hủy là
Đáp án C.

