Bài 11: Phản ứng oxi hóa - khử và ứng dụng trong cuộc sống
Sách chân trời sáng tạo
Dãy chất đều có nguyên tố có số oxi hóa +4 là
Với CO2: Gọi số oxi hóa của C trong hợp chất bằng x
⇒ 1.x+2.(-2)=0 ⇒ x=+4
Với HCO3-: Gọi số oxi hóa của C trong ion là y
⇒ 1.(+1) + 1.y + 3.(-2) = -1 ⇒ y=+4
Với SO2: Gọi số oxi hóa của S trong hợp chất bằng z
⇒ 1.z+2.(-2)=0 ⇒ z=+4
Với H2SO3: Gọi số oxi hóa của S trong hợp chất bằng t
⇒ 2.(+1) + 1.t + 3.(-2) = 0 ⇒ t=+4
Dãy chất đều có nguyên tố có số oxi hóa +4 là CO2, HCO3-, SO2, H2SO3.
Cho phản ứng sau: \(KMn{O_4} + {H_2}S{O_4} \to MnS{O_4} + {K_2}S{O_4} + {O_2} + {H_2}O\). Tỉ lệ về số mol giữa O2 với H2SO4 là
Bước 1. Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
\(K\mathop {Mn}\limits^{ + 7} \mathop {{O_4}}\limits^{ - 2} + {H_2}S\mathop {{O_4}}\limits^{ - 2} \to \mathop {Mn}\limits^{ + 2} S{O_4} + {K_2}S{O_4} + \mathop {{O_2}}\limits^0 {\rm{ \;}} + {H_2}O\)
Bước 2. Biểu diễn quá trình oxi hóa, quá trình khử
\(\left| {\begin{array}{*{20}{c}}{\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} }\\{\mathop {2O}\limits^{ - 2} \to \mathop {{O_2} + 4e}\limits^0 }\end{array}} \right.\)
Bước 3. Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc của phương pháp thăng bằng electron
.png)
Bước 4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
\(4KMn{O_4} + 6{H_2}S{O_4} \to 4MnS{O_4} + 2{K_2}S{O_4} + 5{O_2} + 6{H_2}O\)
Tỉ lệ về số mol giữa O2 với H2SO4 là 5:6
Xét phản ứng: \(Fe + HN{O_3} \to F{e^{3 + }} + X + {H_2}O\). X là chất nào để tổng số electron Fe nhường là 24?
Với X là N2O
Bước 1. Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
\(\mathop {Fe}\limits^0 {\rm{ \;}} + H\mathop {{\rm{ }}N}\limits^{ + 5} {O_3} \to F{e^{3 + }} + \mathop {{N_2}}\limits^{ + 1} O + {H_2}O\)
Bước 2. Biểu diễn quá trình oxi hóa, quá trình khử
\(\left| {\begin{array}{*{20}{c}}{\mathop {2N}\limits^{ + 5} + 8e \to \mathop {2N}\limits^{ + 1} }\\{\mathop {Fe}\limits^0 \to \mathop {Fe}\limits^{ + 3} + 3e}\end{array}} \right.\)
Bước 3. Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc của phương pháp thăng bằng electron
.png)
⇒ Với X là N2O thì tổng số electron Fe nhường là 3.8=24
Trong phản ứng oxi hóa – khử, chất khử là
Trong phản ứng oxi hóa – khử, chất khử là chất nhường electron (hay chất có số oxi hóa thay đổi từ thấp lên cao)
Trong phản ứng hóa học: \(Al + HCl \to AlC{l_3} + {H_2}\), mỗi nguyên tử Al
Al có số oxi hóa thay đổi từ 0 lên +3 trong AlCl3 nên Al là chất khử ⇒ Al nhường 3 electron
\(\mathop {Al}\limits^0 {\rm{ \;}} + \mathop {{\rm{ }}H}\limits^{ + 1} Cl \to \mathop {Al}\limits^{ + 3} C{l_3} + \mathop {{H_2}}\limits^0 \)
Trong phản ứng hóa học: \(2Na + 2{H_2}O \to 2NaOH + {H_2}\), xảy ra quá trình khử chất nào?
\(2\mathop {Na}\limits^0 + 2\mathop {{H_2}}\limits^{ + 1} O \to 2\mathop {Na}\limits^{ + 1} OH + \mathop {{H_2}}\limits^0 \)
⇒ Chất oxi hóa là H2O (có sự thay đổi từ số oxi hóa cao xuống số oxi hóa thấp)
⇒ Qúa trình khử nước
Cho phản ứng hóa học sau:
\(Cu + {H_2}S{O_4} \to CuS{O_4} + {H_2}S + {H_2}O\)
Một bạn học sinh thực hiện các bước sau để cân bằng phản ứng trên:
Bước 1: Xác định chất oxi hóa, chất khử
Chất oxi hóa: H2SO4, chất khử: Cu
Bước 2: Viết các quá trình oxi hóa, quá trình khử
\(Cu \to C{u^{ + 2}} + 2e\) \({S^{ + 6}} + 4e \to {S^{ - 2}}\)
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc thăng bằng electron
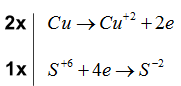
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
\(2Cu + 3{H_2}S{O_4} \to 2CuS{O_4} + {H_2}S + 3{H_2}O\)
Tuy nhiên phương trình này chưa được cân bằng.
Nội dung của nguyên tắc thăng bằng electron mà bạn học sinh sử dụng ở trên là như thế nào?
Nội dung của nguyên tắc thăng bằng electron: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
Cho phản ứng hóa học sau:
\(Cu + {H_2}S{O_4} \to CuS{O_4} + {H_2}S + {H_2}O\)
Một bạn học sinh thực hiện các bước sau để cân bằng phản ứng trên:
Bước 1: Xác định chất oxi hóa, chất khử
Chất oxi hóa: H2SO4, chất khử: Cu
Bước 2: Viết các quá trình oxi hóa, quá trình khử
\(Cu \to C{u^{ + 2}} + 2e\) \({S^{ + 6}} + 4e \to {S^{ - 2}}\)
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc thăng bằng electron
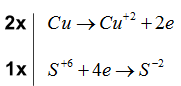
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
\(2Cu + 3{H_2}S{O_4} \to 2CuS{O_4} + {H_2}S + 3{H_2}O\)
Tuy nhiên phương trình này chưa được cân bằng.
Phương trình trên chưa được cân bằng do sai ở
Bước 2 ở quá trình khử
Sửa lại \({S^{ + 6}} + 8e \to {S^{ - 2}}\)
Cho phản ứng hóa học sau:
\(Cu + {H_2}S{O_4} \to CuS{O_4} + {H_2}S + {H_2}O\)
Một bạn học sinh thực hiện các bước sau để cân bằng phản ứng trên:
Bước 1: Xác định chất oxi hóa, chất khử
Chất oxi hóa: H2SO4, chất khử: Cu
Bước 2: Viết các quá trình oxi hóa, quá trình khử
\(Cu \to C{u^{ + 2}} + 2e\) \({S^{ + 6}} + 4e \to {S^{ - 2}}\)
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc thăng bằng electron
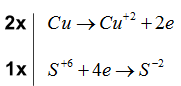
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
\(2Cu + 3{H_2}S{O_4} \to 2CuS{O_4} + {H_2}S + 3{H_2}O\)
Tuy nhiên phương trình này chưa được cân bằng.
Cân bằng lại phương trình trên cho đúng, tổng hệ số cân bằng của các chất trong phương trình trên là
Bước 1: Xác định chất oxi hóa, chất khử
Chất oxi hóa: H2SO4, chất khử: Cu
Bước 2: Viết các quá trình oxi hóa, quá trình khử
\(Cu \to C{u^{ + 2}} + 2e\)
\({S^{ + 6}} + 8e \to {S^{ - 2}}\)
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc thăng bằng electron
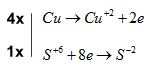
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
\(4Cu + 5{H_2}S{O_4} \to 4CuS{O_4} + {H_2}S + 4{H_2}O\)
⇒Tổng hệ số cân bằng của các chất trong phương trình trên là 4 + 5 + 4 + 1 + 4 = 18
Xét phản ứng sau: $F{e_2}{O_3} + 3{H_2}\xrightarrow{{{t^o}}}2Fe + 3{H_2}O$. Phát biểu nào sau đây không đúng?
Các nguyên tử có số oxi hóa biến đổi là Fe, H. Cụ thể
Fe từ +3 (trong Fe2O3) xuống 0 (trong Fe) => Fe2O3 là chất oxi hóa và bị khử
H từ 0 (trong H2) lên +1 (trong H2O) => H2 là chất khử và bị oxi hóa
Khí thiên nhiên nén (CNG – Compressed Natural Gas) có thành phần chính là methane (CH4), là nhiên liệu sạch, thân thiện với môi trường. Xét phản ứng đốt cháy methane trong buồng đốt động cơ xe buýt sử dụng nhiên liệu CNG: $C{H_4} + {O_2}\xrightarrow{{{t^o}}}C{O_2} + {H_2}O$. Phát biểu nào sau đây không đúng?
Các nguyên tử thay đổi số oxi hóa là C, O
\(\begin{array}{*{20}{c}}{1x}\\{\mathop {2x}\limits^{} }\end{array}\left| {\begin{array}{*{20}{c}}{\mathop C\limits^{ - 4} \to \mathop C\limits^{ + 4} + 8e}\\{\mathop {{O_2}}\limits^0 + 4e \to 2\mathop O\limits^{ - 2} }\end{array}} \right.\) => CH4 là chất khử và bị oxi hóa, O2 là chất oxi hóa và bị khử (A, B đúng)
=> Phương trình cân bằng là: $C{H_4} + 2{O_2}\xrightarrow{{{t^o}}}C{O_2} + 2{H_2}O$
Tính toán theo phương trình cân bằng trên thì số mol O2 cần dùng khi đốt cháy 1 mol methane là 2 mol => Ở 25oC, 1 bar: \({V_{{O_2}}} = 2.24,79 = 49,58\)lít (C đúng)
=> Tổng số cân bằng của phương trình là 1+2+1+2=6 (D sai)
Copper (II) sulfate được sử dụng làm nguyên liệu trong phân bón, làm thuốc kháng nấm. Ngoài ra, còn dùng để diệt rêu – tảo trong bể bơi,…. Copper (II) sulfate được sản xuất chủ yếu sử dụng từ nguồn nguyên liệu tái chế. Phế liệu được tinh chế cùng kim loại nóng chảy được đổ vào nước để tạo thành những mảnh xốp. Hỗn hợp này được hòa tan trong dung dịch sulfuric acid loãng trong không khí theo phương trình: \(Cu + {O_2} + {H_2}S{O_4} \to CuS{O_4} + {H_2}O\)(1). Ngoài ra, copper (II) sulfate còn được điều chế bằng cách cho đồng phế liệu tác dụng với dung dịch sunfuric acid đặc, nóng: \(Cu + {H_2}S{O_4} \to CuS{O_4} + S{O_2} + {H_2}O\)(2). Phát biểu nào sau đây không đúng?
\(\begin{array}{*{20}{c}}{2x}\\{\mathop {1x}\limits^{} }\end{array}\left| {\begin{array}{*{20}{c}}{\mathop {Cu}\limits^0 \to \mathop {Cu}\limits^{ + 2} + 2e}\\{\mathop {{O_2}}\limits^0 + 4e \to \mathop {2O}\limits^{ - 2} }\end{array}} \right.\) => Phương trình cân bằng của (1) là: \(2Cu + {O_2} + 2{H_2}S{O_4} \to 2CuS{O_4} + 2{H_2}O\)
\(\begin{array}{*{20}{c}}{1x}\\{\mathop {1x}\limits^{} }\end{array}\left| {\begin{array}{*{20}{c}}{\mathop {Cu}\limits^0 \to \mathop {Cu}\limits^{ + 2} + 2e}\\{\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} }\end{array}} \right.\) => Phương trình cân bằng của (2) là: \(Cu + 2{H_2}S{O_4} \to CuS{O_4} + S{O_2} + 2{H_2}O\)
A đúng vì không sinh ra khí SO2 gây ô nhiễm môi trường
Với cùng một lượng đồng phế thải thì sử dụng cả cách trên đều cho cùng lượng CuSO4 (B sai) do số mol của Cu và của CuSO4 trong cả hai phương trình đều bằng nhau
Tổng hệ số cân bằng của (1) là 9. Tổng hệ số cân bằng của (2) là 7
=> Tổng hệ số cân bằng của (1) và (2) là 16 (C đúng)
D đúng. (1) và (2) đều có chất khử là Cu. (1) có chất oxi hóa là O2, (2) có chất oxi hóa là H2SO4
Cho các hợp chất sau: N2O, NH4Cl, HNO3, NO2. Chiều sắp xếp tăng dần về số oxi hóa của nguyên tử nitrogen trong các hợp chất trên là
N2O: N có số oxi hóa là +1
NH4Cl: N có số oxi hóa là -3
HNO3: N có số oxi hóa là +5
NO2: N có số oxi hóa là +4
=> Chiều sắp xếp tăng dần về số oxi hóa của nguyên tử nitrogen trong các hợp chất trên là
NH4Cl, N2O, NO2, HNO3
Kim loại chuyển tiếp rhenium (Re) là một trong những nguyên tố hiếm nhất trong vỏ Trái Đất. Rhenium chủ yếu được sử dụng ở dạng hợp kim với nickel để chế tạo các bộ phận của động cơ phản lực. Phản ứng hoá học chưa cân bằng để điều chế Re kim loại từ ammonium perrhenate xảy ra như sau:
\(N{H_4}{\mathop{\rm Re}\nolimits} {O_4} + {H_2} \to {\mathop{\rm Re}\nolimits} + {H_2}O + N{H_3}\)
Tổng hệ số nguyên nhỏ nhất của phản ứng trên là
\(2N{H_4}{\mathop{\rm Re}\nolimits} {O_4} + 7{H_2} \to 2{\mathop{\rm Re}\nolimits} + 8{H_2}O + 2N{H_3}\)
=> Tổng hệ số nguyên nhỏ nhất của phản ứng là 2 + 7 + 2 + 8 +2 = 21
Chromium là một trong những kim loại có độ cứng lớn nhất. Cụm từ chromium xuất phát từ tiếng Hy Lạp, có nghĩa là “màu sắc” do các hợp chất của chromium thường có màu sắc rất đậm. Hình dưới đây cho biết màu sắc một số hợp chất của chromium theo thứ tự CrCl2, CrCl3, K2CrO4, K2Cr2O7

Số oxi hoá của Cr trong các hợp chất CrCl2, CrCl3, K2CrO4, K2Cr2O7 lần lượt là
Trong các hợp chất trên, số oxi hoá của Cl là -1, của K là +1 và của O là -2
Áp dụng các quy tắc xác định số oxi hoá:
=> Số oxi hoá của Cr trong các hợp chất CrCl2, CrCl3, K2CrO4, K2Cr2O7 lần lượt là +2, +3, +6, +6
Trong công nghiệp, quy trình sản xuất nitric acid theo sơ đồ chuyển hoá sau:
${N_2}\xrightarrow{{(1)}}N{H_3}\xrightarrow{{(2)}}NO\xrightarrow{{(3)}}N{O_2}\xrightarrow{{(4)}}HN{O_3}$
Có ít nhất bao nhiêu phản ứng thuộc loại phản ứng oxi hoá – khử?
(1) \({N_2} + 3{H_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}\)
(2) \(2N{H_3} + 2{O_2} \to NO + 3{H_2}O\)
(3) \(2NO + {O_2} \to 2N{O_2}\)
(4) \(2N{O_2} + {\textstyle{1 \over 2}}{O_2} + {H_2}O \to 2HN{O_3}\)
=> Có ít nhất 4 phản ứng thuộc loại phản ứng oxi hoá – khử
Cho sơ đồ chuyển hoá sau: $S\xrightarrow{{(1)}}FeS\xrightarrow{{(2)}}{H_2}S\xrightarrow{{(3)}}{H_2}S{O_4}\xrightarrow{{(4)}}S{O_2}\xrightarrow{{(5)}}S$. Có ít nhất bao nhiêu phản ứng thuộc loại phản ứng oxi hoá – khử?
(1) $S + Fe\xrightarrow{{{t^o}}}FeS$
(2) \(FeS + 2HCl \to FeC{l_2} + {H_2}S \uparrow \)
(3) \({H_2}S + CuS{O_4} \to CuS \downarrow + {H_2}S{O_4}\)
(4) \({H_2}S{O_4} + N{a_2}S{O_3} \to N{a_2}S{O_4} + S{O_2} \uparrow + {H_2}O\)
(5) \(S{O_2} + 2{H_2}S \to S + 2{H_2}O\)
=> Có ít nhất 2 phản ứng thuộc phản ứng oxi hoá – khử là (1) và (5)
Hàm lượng cho phép của tạp chất sulfur trong nhiên liệu là 0,3%. Người ta đốt cháy hoàn toàn 150 gam một nhiên liệu và dẫn sản phẩm cháy (giả thiết chỉ có CO2, SO2 và hơi nước) qua dung dịch KMnO4 5.10-3 M trong H2SO4 thì thấy thể tích dung dịch KMnO4 đã phản ứng vừa hết với lượng sản phẩm cháy trên là 825 ml. Phát biểu nào sau đây không đúng?
\(S + {O_2} \to S{O_2}\) (1)
\(5S{O_2} + 2KMn{O_4} + 2{H_2}O \to {K_2}S{O_4} + 2MnS{O_4} + 2{H_2}S{O_4}\) (2)
Từ (1) và (2) \({n_S} = {n_{S{O_2}}} = \dfrac{5}{2}{n_{KMn{O_4}}} = \dfrac{5}{2}{.5.10^{ - 3}}.0,825 = \dfrac{{33}}{{3200}}mol\) (D đúng)
=> Hàm lượng phần trăm S là \(\dfrac{{\dfrac{{33}}{{3200}}.32}}{{150}}.100\% = 0,22\% < 0,3\% \) (A đúng)
=> Nhiên liệu trên được phép sử dụng (B đúng)
C sai. Từ phương trình (2) suy ra số phân tử KMnO4 bị khử bởi SO2 là 2

