Cho phản ứng hóa học sau:
\(Cu + {H_2}S{O_4} \to CuS{O_4} + {H_2}S + {H_2}O\)
Một bạn học sinh thực hiện các bước sau để cân bằng phản ứng trên:
Bước 1: Xác định chất oxi hóa, chất khử
Chất oxi hóa: H2SO4, chất khử: Cu
Bước 2: Viết các quá trình oxi hóa, quá trình khử
\(Cu \to C{u^{ + 2}} + 2e\) \({S^{ + 6}} + 4e \to {S^{ - 2}}\)
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc thăng bằng electron
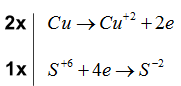
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế
\(2Cu + 3{H_2}S{O_4} \to 2CuS{O_4} + {H_2}S + 3{H_2}O\)
Tuy nhiên phương trình này chưa được cân bằng.
Phương trình trên chưa được cân bằng do sai ở
Trả lời bởi giáo viên
Bước 2 ở quá trình khử
Sửa lại \({S^{ + 6}} + 8e \to {S^{ - 2}}\)
Hướng dẫn giải:
Áp dụng các bước lập phương trình oxi hóa – khử để kiểm tra các bước

