I - CẤU TẠO CHẤT
1. Cấu tạo chất
- Các chất được cấu tạo từ các hạt riêng biệt là phân tử
- Các phân tử chuyển động không ngừng
- Các phân tử chuyển động càng nhanh thì nhiệt độ của vật càng cao
- Lực tương tác phân tử:
+ Giữa các phân tử cấu tạo nên vật có lực hút và lực đẩy
+ Khi khoảng cách giữa các phân tử nhỏ thì lực đẩy mạnh hơn lực hút, khi khoảng cách giữa các phân tử lớn thì lực hút mạnh hơn lực đẩy, khi khoảng cách giữa các phân tử rất lớn thì lực tương tác không đáng kể.
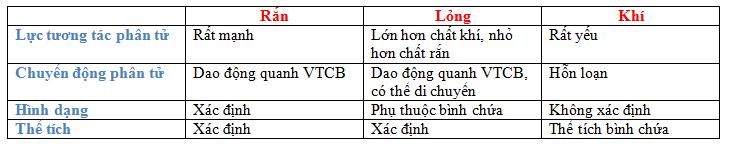
2. Tính chất của chất khí
- Bành trướng: Chiếm toàn bộ thể tích của bình chứa
- Dễ nén: Khi áp suất tác dụng lên một lượng khí tăng thì thể tích của khí giảm đáng kể.
- Có khối lượng riêng nhỏ so với chất rắn và chất lỏng
II - THUYẾT ĐỘNG HỌC PHÂN TỬ CHẤT KHÍ
- Chất khí được cấu tạo từ các phân tử có kích thước rất nhỏ so với khoảng cách giữa chúng.
- Các phân tử khí chuyển động hỗn loạn không ngừng; chuyển động này càng nhanh thì nhiệt độ chất khí càng cao.
- Khi chuyển động hỗn loạn các phân tử khí va chạm vào thành bình gây áp suất lên thành bình.
III - PHÂN LOẠI CHẤT KHÍ
- Khí thực: là các chất khí tồn tại trong thực tế mà ta đã biết như Oxi, Nitơ, Cácboníc, ...
- Khí lí tưởng: là chất khí trong đó các phân tử được coi là các chất điểm và chỉ tương tác khi va chạm.
IV - CÔNG THỨC XÁC ĐỊNH MOL, THỂ TÍCH, KHỐI LƯỢNG CỦA MỘT CHẤT BẤT KỲ
1 mol là lượng chất trong đó có chứa một số phân tử hay nguyên tử bằng số nguyên tử chứa trong 12g cacbon 12.
- Số Avôgađrô NA: là số nguyên tử có trong 1 mol lượng chất bất kỳ.
\({N_A} = {6,022.10^{23}}(mo{l^{ - 1}})\)
- Số mol của chất khí bất kỳ: \(n = \frac{m}{M}\)
Trong đó:
+ \(m\): khối lượng của chất khí (g)
+ \(M\): khối lượng mol của phân tử chất khí (g/mol)
- Nếu xét ở đktc (áp suất 1atm, nhiệt độ \({0^o}C\)): \(n = \frac{V}{{22,4}}\)
Trong đó: \(V\)- thể tích của chất khí (l)
- Số phân tử (hay nguyên tử) N có trong khối lượng m của một chất: \(N = n{N_A} = \frac{m}{M}{N_A}\)
- Mật độ phân tử chất khí (số phân tử có trong 1 đơn vị thể tích): \(n' = \frac{N}{V}\)

