Chúng tôi giới thiệu Giải bài tập Vật Lí lớp 11 Bài 14: Dòng điện trong chất điện phân chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Dòng điện trong chất điện phân lớp 11.
Giải bài tập Vật Lí lớp 11 Bài 14: Dòng điện trong chất điện phân
Trả lời câu hỏi giữa bài
Trả lời câu C1 trang 81 SGK Vật lí 11: Để phân biệt môi trường dẫn diện có phải là chất diện hay không, ta có thể làm cách nào?
Lời giải:
Dòng điện trong chất điện phân không chỉ tải điện lượng mà còn tải vật chất đi theo. Tới điện cực chỉ có các eelectron có thể đi tiếp, còn lượng vật chất đọng lại ở điện cực, gây ra hiện tượng điện phân.
Để phân biệt môi trường dẫn điện có phải là chất điện phân hay không ta xem có vật chất bám lại ở trên điện cực hay không hoặc có một số chất thoát ra.
Trả lời câu C2 trang 83 SGK Vật lí 11: Vì sao các định luật Fa-ra-đây có thể áp dụng cả với các chất được giải phóng ở điện cực nhờ phản ứng phụ?
Lời giải:
Các định luật Fa-ra-đây có thể áp dụng cả với các chất được giải phóng ở điện cực nhờ phản ứng phụ vì khối lượng vật chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận vơi điện lượng chạy qua bình đó.
: đương lượng điện hóa của chất được giải phóng ở điện cực.
Trả lời câu C3 trang 83 SGK Vật lí 11: Có thể tính số nguyên tử trong một mol kim loại từ số Fa- ra – đây được không?
Lời giải:
Theo định luật Fa-ra-đây thứ 2, ta có:
Trong đó:
+ : hóa trị của nguyên tố
+ : khối lượng mol của chất được giải phóng ra ở điện cực
+ đương lượng điện hóa của chất được giải phóng ở điện cực
Theo định luật Fa-ra-đây thứ nhất, ta suy ra:
Lại có điện lượng: (trong đó là số electron tự do chạy qua bình điện phân)
Ta suy ra:
Nếu xét 1 mol kim loại có hóa trị 1 thì => số nguyên tử trong 1mol kim loại là: (hạt/mol)
Trả lời câu C4 trang 84 SGK Vật lí 11: Tại sao khi mạ điện, muốn lớp mã đều. Ta phải quay vật cần mạ trong điện phân?
Lời giải:
Câu hỏi và bài tập (trang 85 sgk Vật lí 11)
Bài 1 trang 85 SGK Vật lí 11: Nội dung của thuyết điện li là gì? Anion thường là phần nào của phân tử?
Lời giải:
Nội dung của thuyết điện li: Trong dung dịch, các hợp chất hóa học như axit, bazơ và muôi bị phân li (một phần hay toàn bộ) thành các nguyên tử hay các nhóm nguyên tử tích điện gọi là iôn, iôn có thể chuyển động tự do trong dung dịch và trở thành hạt tải điện.
Anion là các iôn âm nên là gốc axít hay nhóm OH-.
Bài 2 trang 85 SGK Vật lí 11: Dòng điện trong chất điện phân khác với dòng điện trong kim loại như thế nào?
Lời giải:
- Dòng điện trong chất điện phân là dòng iôn dương và iôn âm chuyển động có huớng theo hai chiều ngược nhau; trong khi đó dòng điện trong kim loại là dòng chuyển dời có hướng của các electrôn tự do.
Sự khác nhau ở đây là khác nhau về loại hạt tải điện.
- Dòng điện trong chất điện phân yếu hơn trong kim loại và dòng điện trong chất điện phân không chỉ tải điện lượng mà còn tải cả vật chất.
Bài 3 trang 85 SGK Vật lí 11: Hãy nói rõ hạt tải điện nào mang dòng điện trên các phần khác nhau của mạch điện có chứa bình điện phân:
a) Dây dẫn và điện cực kim loại.
b) Ở sát bề mặt hai điện cực.
c) Ở trong lòng chất điện phân.
Lời giải:
a) Dây dẫn và điện cực: trên dây dẫn và điện cực kim loại, hạt tải điện là electron.
b) Ở sát bề mặt hai điện cực: ở sát bề mặt anot, hạt tải điện là các ion âm, còn sát bề mặt catot hạt tải điện là các ion dương.
c) Ở trong lòng chất điện phân: ở trong lòng chất điện phân, hạt tải điện là các ion dương và âm.
Bài 4 trang 85 SGK Vật lí 11: Chất điện phân thường dẫn điện tốt hơn hay kém hơn kim loại? Tại sao?
Lời giải:
Chất điện phân thường dẫn điện kém hơn kim loại vì:
- Mật độ các iôn trong chất điện phân thường nhỏ hơn mật độ các êlectron tự do trong kim loại.
- Khối lượng và kích thước của iôn lớn hơn khối lượng và kích thước của êlectron nên tốc độ của chuyển động có hướng của chúng nhỏ hơn so với êlectron.
- Môi trường dung dịch điện phân rất mất trật tự nên các iôn bị cản trở nhiều hơn so với các êlectron trong kim loại.
Bài 5 trang 85 SGK Vật lí 11: Hai bể điện phân: bể A để luyện nhôm, bể B để mạ niken. Hỏi bể nào có dương cực tan? Bể nào có suất phản điện?
Lời giải:
+ Bể A để luyện nhôm có cực dương bằng than (graphit) nên không có hiện tượng cục dương tan.
+ Bể B để mạ niken có cực dương là niken và chất điện phân NiSO4 thì sẽ có cực dương tan.
+ Bể nào không có cực dương tan thì sẽ đóng vai trò là máy thu và khi đó có suất phản điện ⇒ bể A để luyện nhôm có suất phản điện.
Bài 6 trang 85 SGK Vật lí 11: Phát biểu định luật Pha-ra-đây, viết công thức Fa-ra-đây và đơn vị dùng trong công thức này.
Lời giải:
- Định luật Fa-ra-đây thứ nhất:
Khối lượng vật chất được giải phóng ở điện cực của bình điện phân tỉ lệ với điện lượng chạy qua bình đó.
Công thức:
Với k là đương lượng điện hóa (đơn vị kg/C).
- Định luật Fa-ra-đây thứ hai:
Đương lượng điện hóa k của một nguyên tố tí lệ với đương lượng gam của nguyên tố đó.
Hệ số tỉ lê là , trong đó gọi là số fa-ra-đây .
Công thức:
Trong đó, I là cường độ dòng điện không đối đi qua bình điện phân (đơn vị A) và t là thời gian dòng điện chạy qua bình (đơn vị s).
Bài 7 trang 85 SGK Vật lí 11: Khi điện phân dung dịch H2SO4 với điện cực bằng graphit, thì ta thu được khí oxi bay ra. Có thể dùng công thức Fa-ra-đây để tìm khối lượng oxi bay ra được không?
Lời giải:
Bài 8 trang 85 SGK Vật lí 11: Phát biểu nào là chính xác
Dòng điện trong chất điện phân là dòng chuyển dời có hướng của
A. Các chất tan trong dung dịch.
B. Các ion dương trong dung dịch.
C. Các ion dương và ion âm dưới tác dụng của điện trường trong dung dịch.
D. Các ion dương và ion âm theo chiều điện trường trong dung dịch.
Phương pháp giải:
Lời giải:
Đáp án C.
Dòng điện trong chất điện phân là dòng chuyển dời có hướng của các ion dương và ion âm dưới tác dụng của điện trường trong dung dịch.
Bài 9 trang 85 SGK Vật lí 11: Phát biểu nào là chính xác
Kết quả cuối cùng của quá trình điện phân dung dịch CuSO4 với điện cực bằng đồng là
A. Không có thay đổi gì ở bình điện phân.
B. Anôt bị ăn mòn
C. Đồng bám vào catôt.
D. Đồng chạy từ anôt sang catôt.
Phương pháp giải:Lời giải:
Đáp án D
Kết quả cuối cùng của quá trình điện phân dung dịch CuSO4 với điện cực bằng đồng là đồng chạy từ anôt sang catôt.
Bài 10 trang 85 SGK Vật lí 11: Tốc độ chuyển động có hướng của ion Na+ và Cl- trong nước có thể tính theo công thức: v = μE, trong đó E là cường độ điện trường, μ có giá trị lần lượt là 4,5.10-8 m2/(V.s) và 6,8.10-8 m2/(V.s). Tính điện trở suất của dung dịch NaCl nồng độ 0,1 mol/l, cho rằng toàn bộ các phân tử NaCl đều phân li thành ion.
Phương pháp giải:
- Công thức tính điện trở:
- Hệ thức định luật Ôm: I = U/R
Lời giải:
+ Điện trở của một khối vật dẫn có thể tính theo hai cách:
Trong đó cường độ điện trường:
+ Cường độ dòng điện I đo bằng tổng điện lượng chạy qua diện tích S của dây dẫn trong 1 giây.
Nếu vNa và vCl là tốc độ có hướng của ion Na và Cl; n là mật độ các ion này thì ta có:
Với
Bài 11 trang 85 SGK Vật lí 11: Người ta muốn bóc một lớp đồng dày trên một bản đồng diện tích bằng phương pháp điện phân. Cường độ dòng điện là . Tính thời gian cần thiết để bóc được lớp đồng. Cho biết đồng có khối lượng riêng là .
Phương pháp giải:
+ Khối lượng:
( là khối lượng riêng)
+ Khối lượng của chất được giải phóng ở điện cực khi điện phân:
(A là khối lượng mol nguyên tử của chất; n là hoá trị của nguyên tố tạo ra ion)
Lời giải:Đổi đơn vị: ;
Khối lượng đồng phải bóc đi là:
Theo công thức Fa - ra - đây:
Với
= 44,73 phút.
Lý thuyết Bài 14: Dòng điện trong chất điện phân
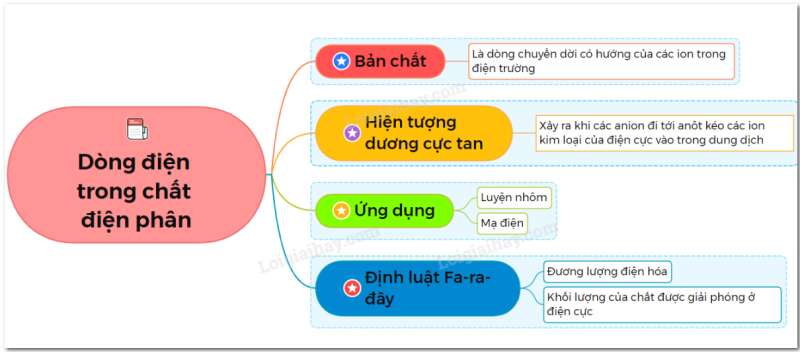
I. Bản chất dòng điện trong chất điện phân
1. Thuyết điện li
Trong dung dịch, các hợp chất hóa học như axit, bazơ và muối bị phân li (một phần hoặc toàn bộ) thành các nguyên tử (hoặc nhóm nguyên tử) tích điện gọi là ion; ion có thể chuyển động tự do trong dung dịch và trở thành hạt tải điện.
2. Bản chất dòng điện trong chất điện phân
- Dòng điện trong chất điện phân là dòng ion dương và ion âm chuyển động có hướng theo hai chiều ngược nhau.
+ Ion dương chạy về phía catôt nên gọi là cation
+ Ion âm chạy về phía anôt nên gọi là anion.
- Dòng điện trong chất điện phân không chỉ tải điện lượng mà còn tải cả vật chất (theo nghĩa hẹp) đi theo. Tới điện cực chỉ có êlectron có thể đi tiếp, còn lượng vật chất đọng lại ở điện cực, gây ra hiện tượng điện phân.
- Chất điện phân không dẫn điện tốt bằng kim loại.
II. Các hiện tượng diễn ra ở điện cực. Hiện tượng dương cực tan
Ta xét chi tiết những gì xảy ra ở điện cực của bình điện phân dung dịch CuSO4 có điện cực bằng đồng bình điện phân này thuộc loại đơn giản nhất, vì chất tan là muối của kim loại dùng làm điện cực (trường hợp này là đồng)
Khi dòng điện chạy qua, cation Cu2+ chạy về catôt, về nhận electron từ nguồn điện đi tới. Ta có ở các điện cực:
+ Ở catốt: Cu2+ + 2e- → Cu
+ Ở anốt: Cu → Cu2+ + 2e-
Khi anion (SO4)2- chạy về anôt, nó kéo ion Cu2+ vào dung dịch. Như vậy, đồng ở anôt sẽ tan dần vào trong dung dịch. Đó là hiện tượng dương cực tan.
Vậy:
- Các ion chuyển động về các điện cực có thể tác dụng với chất làm điện cực hoặc với dung môi tạo nên các phản ứng hóa học gọi là phản ứng phụ trong hiện tượng điện phân.
- Hiện tượng dương cực tan xảy ra khi các anion đi tới anot kéo các ion kim loại của điện cực vào trong dung dịch.
III. Các định luật Fa-Ra-Đây
Vì dòng điện trong chất điện phân tải điện lượng cùng với vật chất (theo nghĩa hẹp) nên khối lượng chất đi đến điện cực:
- Tỉ lệ thuận với điện lượng chạy qua bình điện phân
- Tỉ lệ thuận với khố lượng của ion (hay khối lượng mol nguyên tử A của nguyên tố tạo nên ion ấy);
- Tỉ lệ nghịch với điện tích của ion (hay hoá trị n của nguyên tố tạo ra ion ấy)
1. Định luật Fa-ra-đây thứ nhất
Khối lượng vật chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó
m = kq
k gọi là đương lượng điện hoá của chất được giải phóng ở điện cực.
2. Định luật Fa-ra-đây thứ hai
Đương lượng điện hoá k của một nguyên tố tỉ lệ với đương lượng gam của nguyên tố đó. Hệ số tỉ lệ là , trong đó F gọi là số Fa-ra-đây
k = .
Thí nghiệm cho thấy, nếu I tính bằng ampe, t tính bằng giây thì:
F = 96 494 C/mol
* Kết hợp hai định luật Fa-ra-đây, ta được công thức Fa-ra-đây:
m = ..It
m là lượng chất được giải phóng ở điện cực, tính bằng gam.
IV. Ứng dụng của hiện tượng điện phân
Một số ứng dụng của hiện tượng điện phân:
- Điều chế hoá chất: điều chế clo, hiđrô và xút trong công nghiệp hoá chất.
- Luyện kim: người ta dựa vào hiện tượng dương cực tan để tinh chế kim loại. Các kim loại như đồng, nhôm, magiê và nhiều hoá chất được điều trực tiếp bằng phương pháp điện phân
- Mạ điện: người ta dùng phương pháp điện phân để phủ một lớp kim loại không gỉ như crôm, niken, vàng, bạc... lên những đồ vật bằng kim loại khác.
Sơ đồ tư duy về dòng điện trong chất điện phân
Dạng 1: Điện phân có dương cực tan
- Khi có hiện tượng dương cực tan, dòng điện trong chất điện phân tuân theo định luật Ôm giống như đoạn mạch chỉ có điện trở thuần R (vì khi đó có một cực bị tan nên bình điện phân xem như một điện trở).
- Sử dụng định luật Faraday:
+ Định luật I: Khối lượng m của chất được giải phóng ra ở điện cực tỉ lệ với điện lượng q chạy qua bình điện phân đó:
Biểu thức: (1)
Trong đó: k (kg/C) gọi là đương lượng điện hóa phụ thuộc vào bản chất của các chất được giải phóng.
+ Định luật II: Đương lượng điện hóa của một nguyên tố tỉ lệ với đương lượng gam của nguyên tố đó.
Biểu thức: (2) với
- Kết hợp (1) và (2) ta có biểu thức định luật Faraday:
Dạng 2: Điện phân không có dương cực tan
- Khi không có hiện tượng dương cực tan thì bình điện phân xem như một máy thu điện nên dòng điện qua bình điện phân tuân theo định luật Ômm cho đoạn mạch chứa máy thu.
- Để giải ta sử dụng:
+ Biểu thức định luật Faraday:
+ Khối lượng riêng:
+ Thể tích:
Trong đó:
D: khối lượng riêng (kg/m3)
d: bề dày kim loại bám vào điện cực (m)
S: diện tích mặt phủ của tấm kim loại (m2)
V: thể tích kim loại bám vào điện cực (m3)
Bài tập ví dụ:
Cho mạch điện như hình vẽ có , và một bình điện phân đựng dung dịch CuSO4, anôt bằng Cu và điện trở của bình điện phân . Tính:
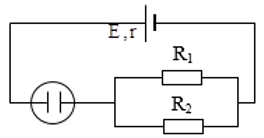
a) Cường độ dòng điện chạy qua mạch chính.
b) Khối lượng đồng thoát ra ở cực dương trong 16 phút 5 giây.
Hướng dẫn giải
Khi điện phân một dung dịch muối mà kim loại anôt làm bằng chính kim loại ấy thì xảy ra hiện tượng cực dương tan.
a)
Ta có: Rp nt(R1 // R2 )
Suy ra điện trở tương đương của mạch ngoài là:
Cường độ dòng điện qua mạch chính:
b)
Khối lượng Cu thoát ra ở cực dương là:

