Đốt cháy 21 gam chất X là dẫn xuất benzen (CTPT trùng với CTĐGN), thu được 23,52 lit CO2 (đktc) và 10,8 gam H2O. Mặt khác, 21 gam X tác dụng vừa đủ với dung dịch NaOH thu được 27,6 gam muối. Số CTCT của X là:
Trả lời bởi giáo viên
Vì đốt cháy X thu được CO2 và H2O → trong X chứa C, H và có thể có O
${n_{C{O_2}}} = \frac{{23,52}}{{22,4}}= 1,05\,mol;\,{n_{{H_2}O}} = \frac{{10,8}}{{18}} = 0,6\,\,mol$
Áp dụng định luật bảo toàn khối lượng: ${m_X} + {m_{{O_2}}} = {m_{C{O_2}}} + {m_{{H_2}O}}$
→ ${m_{{O_2}}}$ = 1,05.44 + 0,6.18 – 21 = 36 gam → ${n_{{O_2}}}$ = 1,125 mol
Nhận thấy: $2.{n_{{O_2}}} < 2.{n_{C{O_2}}} + {n_{{H_2}O}}$→ trong X chứa O
Áp dụng định luật bảo toàn nguyên tử:
nO trong X = $2.{n_{C{O_2}}} + {n_{{H_2}O}} - 2.{n_{{O_2}}}$= 2.1,05 + 0,6 – 2.1,125 = 0,45 mol
nC trong X = ${n_{C{O_2}}}$= 1,05 mol
nH trong X = 2.${n_{{H_2}O}}$= 1,2 mol
→ nC : nH : nO = 1,05 : 1,2 : 0,45 = 7 : 8 : 3 → CTĐGN của X là C7H8O3
Vì CTPT của X trùng với CTĐGN → CTPT của X là C7H8O3
${n_{{C_7}{H_8}{O_3}}} = \,\,\frac{{21}}{{140}}\,\, = \,\,0,15\,\,mol$
X tác dụng với dung dịch NaOH:
Cứ thay thế 1 nguyên tử H bằng 1 nguyên tử Na thì khối lượng tăng: 23 – 1 = 22
Mà theo bài, khối lượng tăng 27,6 – 21 = 6,6 gam
+)số mol NaOH phản ứng là: nNaOH = $\frac{{6,6}}{{22}}$ = 0,3 mol
→ ${n_{{C_7}{H_8}{O_3}}} = 2{n_{NaOH}}$ → trong X có 2 nhóm -OH tác dụng với NaOH
→ X có 2 nhóm -OH phenol và 1 nhóm -OH ancol hoặc X có 2 nhóm -OH phenol và 1 nhóm ete
Các CTCT của X là
TH1
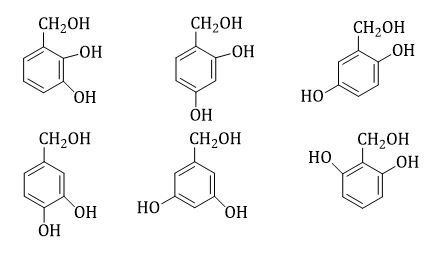
TH2: Thay -CH2OH bằng -OCH3 (6 công thức)
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng: ${m_X}\, + \,\,{m_{{O_2}}}\, = \,\,{m_{C{O_2}}} + \,{m_{{H_2}O}}$
Nhận thấy: 2$2.{n_{{O_2}}} < 2.{n_{C{O_2}}} + {n_{{H_2}O}}$→ trong X chứa O
Áp dụng định luật bảo toàn nguyên tử:
nO trong X = 2$2.{n_{C{O_2}}} + {n_{{H_2}O}} - 2.{n_{{O_2}}}$
nC trong X = ${n_{C{O_2}}}$
nH trong X = 2${n_{{H_2}O}}$
→ nC : nH : nO
+) Tính số mol NaOH phản ứng => các nhóm -OH trong X

