Có 2 oxide AO2 và BO2 mà tỉ lệ phân tử lượng: MAO2:MBO2=11:16. Tỉ lệ thành phần khối lượng của A và B trong oxide theo thứ tự là 6:11. Cho các phát biểu sau:
(1) Oxide AO2 và BO2 đều tan trong nước tạo dung dịch acid yếu.
(2) A và B đều có 3 electron độc thân ở trạng thái cơ bản.
(3) Trong AO2 có 2 liên kết pi và 2 liên kết sigma.
(4) Cả AO3 và BO3 đều có thể tồn tại.
Số phát biểu đúng là
Trả lời bởi giáo viên
Đặt khối lượng mol của nguyên tử A, B lần lượt là A g/mol, B g/mol. Theo giả thiết:
A+32B+32=1116(1)
Thành phần khối lượng của A trong AO2 là AA+32
Thành phần khối lượng của B trong BO2 là BB+32
Theo giả thiết AA+32:BB+32=611(2)
Từ (1) và (2) Þ B = 32, A = 12.
Vậy A là cacbon; B là S (lưu huỳnh)
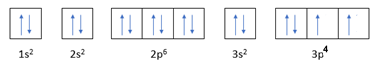
C (Z = 6): 1s22s22p2 (Có 2 electron độc thân)
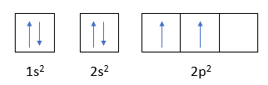
S (Z = 16): 1s22s22p63s23p4 (Có 2 electron độc thân)
CO2 có công thức electron và công thức cấu tạo
![]()
C đã sử dụng 4 electron ngoài cùng để tạo 4 liên kết, do đó không thể hình thành phân tử CO3
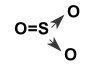
Tương tự, SO2 có
![]()
S mới sử dụng 4e tạo liên kết, còn 1 cặp electron ngoài cùng để tạo liên kết với 1 nguyên tử O nữa nên có thể hình thành phân tử SO3
=> Số phát biểu đúng là (1), (3)
Hướng dẫn giải:
- Tìm A, B
- Áp dụng tính chất, đặc điểm về cấu hình electron của A, B và hợp chất oxide của chúng