Kết quả:
0/30
Thời gian làm bài: 00:00:00
Mỗi lớp electron phân chia thành các phân lớp, được kí hiệu bằng các chữ cái
Nguyên tử nào sau đây có khuynh hướng đạt cấu hình electron bền của khí hiếm argon khi tham gia hình thành liên kết hóa học?
Số electron lớp ngoài cùng của ion S2- (Z = 16) là:
Vỏ nguyên tử chứa hạt
Trong 1 orbital chứa tối đa bao nhiêu electron?
Tính chất nào không phải của hợp chất ion?
Những nguyên tử có đặc điểm như thế nào được gọi là các đồng vị của một nguyên tố hóa học?
Cho sơ đồ mô tả sự dùng chung cặp electron giữa hai nguyên tử chlorine tạo thành phân tử chlorine:
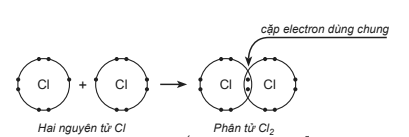
Số electron hóa trị và số electron đóng góp cho sự dùng chung của mỗi nguyên tử chlorine là
Số cột của nhóm A và nhóm B trong bảng tuần hoàn hóa học lần lượt là
Phân tử HCl (hydrogen chloride) được tạo thành bởi liên kết cộng hóa trị. Mô tả nào sau đây đúng khi nói về sự tạo thành phân tử HCl?
Theo quy tắc bát tử thì nguyên tử của nguyên tố X có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình electron bền vững của các khí hiếm với a electron ở lớp ngoài cùng. Giá trị của a là
Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành
Nguyên tử M có Z=23. Vị trí của M trong bảng tuần hoàn là
Trong một nhóm A theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử
Khi tham gia hình thành liên kết hóa học, các nguyên tử calcium và oxygen có khuynh hướng đạt cấu hình electron bền của lần lượt các khí hiếm nào sau đây?
Phát biểu nào không đúng?
Liên kết hydrogen và tương tác van der Waals đều làm thay đổi nhiệt độ sôi, nhiệt độ nóng chảy của các chất như thế nào?
Cho số hiệu nguyên tử của aluminum là 13. Aluminum là
Một lưỡng cực tạm thời được tạo thành khi có
Liên kết cộng hóa trị được hình thành do sự xen phủ trục của hai orbital là
Nguyên tử X có tổng số các hạt là 58, trong đó hạt mang điện nhiều hơn hạt không mang điện là 18. Kí hiệu của nguyên tử X là
Nguyên tử X có tổng số các hạt là 49, trong đó số hạt không mang điện bằng 53,125% số hạt mang điện. Số proton, electron, neutron trong X lần lượt là
Phosphorus (P) là nguyên tố thuộc nhóm VA, chu kì 3 của bảng tuần hoàn. Cho các phát biểu sau:
(1) Nguyên tử P có 5 electron hóa trị và 8 electron p.
(2) Nguyên tử P có 3 lớp electron và có 2 electron độc thân.
(3) Công thức oxide cao nhất của P có dạng P2O5 và là acidic oxide.
(4) Hydroxide cao nhất của P có dạng H3PO4 và có tính acid.
(5) Nguyên tố P có độ âm điện thấp hơn nguyên tố có số hiệu nguyên tử là 9.
Số phát biểu đúng là
Kí hiệu nguyên tử X là \({}_{16}^{32}X\). Cho các phát biểu sau:
(a) Tổng số hạt mang điện trong X chiếm 66,67% tổng số hạt trong X.
(b) X có số p=số e= số n=16.
(c) X là nguyên tố p.
(d) X có tính phi kim.
(e) X có tính phi kim yếu hơn Y, biết Y có Z=8.
Số phát biểu đúng là
Nguyên tử nào khi nhận thêm electron với lượng ít nhất thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố Ar (Z=18)?
Nguyên tử của nguyên tố A có tổng số electron trong các phân lớp p là 11. Nguyên tử của nguyên tố B có tổng số hạt mang điện ít hơn tổng số hạt mang điện của A là 12. Ion của A và B lần lượt là
X là nguyên tố ở chu kì 3, nhóm IIIA và Y là nguyên tố ở chu kì 2, nhóm VIA. Công thức và loại liên kết của hợp chất tạo bởi X và Y có thể là:
Cho năng lượng liên kết của liên kết C-H là 418 kJ/mol, của liên kết C=C là 612 kJ/mol. Tổng năng lượng liên kết trong phân tử C2H4 là
Chất nào sau đây có thể tạo liên kết hydrogen với chính nó?
Có 2 oxide AO2 và BO2 mà tỉ lệ phân tử lượng: \({M_{A{O_2}}}:{M_{B{O_2}}} = 11:16\). Tỉ lệ thành phần khối lượng của A và B trong oxide theo thứ tự là 6:11. Cho các phát biểu sau:
(1) Oxide AO2 và BO2 đều tan trong nước tạo dung dịch acid yếu.
(2) A và B đều có 3 electron độc thân ở trạng thái cơ bản.
(3) Trong AO2 có 2 liên kết pi và 2 liên kết sigma.
(4) Cả AO3 và BO3 đều có thể tồn tại.
Số phát biểu đúng là

