Kết quả:
0/30
Thời gian làm bài: 00:00:00
Cho phản ứng: Br2 + HCOOH → 2HBr + CO2. Có thể tính tốc độ phản ứng theo
Cho các phương trình nhiệt hóa học sau:
(1) $C(s) + {H_2}O(g)\xrightarrow{{{t^o}}}CO(g) + {H_2}(g)$ \({\Delta _r}H_{298}^0 = + 131,25kJ\)
(2) \(CuS{O_4}(aq) + Zn(s) \to ZnS{O_4}(aq) + Cu(s)\) \({\Delta _r}H_{298}^0 = - 231,04kJ\)
(3) $2{C_2}{H_5}OH(l) + 3{O_2}(g)\xrightarrow{{{t^o}}}2C{O_2}(g) + 3{H_2}O(l)$ \({\Delta _r}H_{298}^0 = - 1366,89kJ\)
(4) $C{H_4}(g) + {H_2}O(l)\xrightarrow{{{t^o}}}CO(g) + 3{H_2}(g)$ \({\Delta _r}H_{298}^0 = + 250kJ\)
(5) \(CaC{O_3}(s) \to CaO(s) + C{O_2}(g)\) \({\Delta _r}H_{298}^0 = + 178,29kJ\)
Số phản ứng tỏa nhiệt và phản ứng thu nhiệt lần lượt là
Đồ thị dưới đây biểu diễn sự phụ thuộc của tốc độ phản ứng vào nồng độ chất phản ứng.

Từ đồ thị trên, ta thấy tốc độ phản ứng
Khi nhiệt độ tăng 10oC thì tốc độ phản ứng
Biết sự tạo thành 1 mol bạc bromide tỏa ra 99,51 kJ nhiệt. Phương trình nhiệt hóa học của quá trình tạo thành bạc bromide từ đơn chất bền tương ứng là
Hình vẽ dưới mô tả sự ảnh hưởng của yếu tố nào đến tốc độ phản ứng giữa X với Y?

Điều chế NH3 từ N2 (g) và H2 (g) làm nguồn chất tải nhiệt, nguồn để điều chế nitric acid và sản xuất phân urea. Biết khi sử dụng 14 g khí N2 sinh ra 45,9 kJ nhiệt. Phương trình nhiệt hóa học của phản ứng tạo thành NH3 là
Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây?
Cho phản ứng hóa học sau:
\(4N{H_{3{\text{ }}(k)}} + 3{O_{2{\text{ }}(k)}}\underset{{{v_n}}}{\overset{{{v_t}}}{\longleftrightarrow}}2{N_{2{\text{ }}(k)}} + 6{H_2}{O_{\left( h \right)}},\Delta H < 0 \)
Có bao nhiêu yếu tố ảnh hưởng đến tốc độ phản ứng trên trong số các yếu tố sau: nhiệt độ, nồng độ, áp suất, diện tích tiếp xúc, chất xúc tác.
Phương trình nhiệt hóa học cho biết
Phát biểu nào sau đây không đúng?
Chất xúc tác là
Người ta sử dụng các biện pháp sau để tăng tốc độ phản ứng:
(1) Dùng khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang).
(2) Nung đá vôi ở nhiệt độ cao để sản xuất vôi sống.
(3) Nghiền nguyên liệu trước khi nung để sản xuất clanhke.
(4) Cho bột sắt làm xúc tác trong quá trình sản xuất NH3 từ N2 và H2.
Trong các biện pháp trên, có bao nhiêu biện pháp đúng?
Cho phản ứng xảy ra với khí độc CO: \(2CO\left( k \right){\rm{ }} + {\rm{ }}{O_2}\left( k \right) \to {\rm{ }}2C{O_2}\left( k \right)\). Biết hệ số nhiệt Van’t Hoff của phản ứng là \(\gamma \) = 2. Nếu tăng nhiệt độ của phản ứng từ 30oC lên 180oC thì tốc độ phản ứng tăng bao nhiêu lần?
Cho phản ứng: \(CaC{O_3}(s) + 2HCl(aq) \to CaC{l_2}(aq) + C{O_2}(g) + {H_2}O(aq)\) và các biện pháp sau:
(1) Tăng nồng độ dung dịch HCl.
(2) Tăng áp suất.
(3) Giảm nhiệt độ.
(4) Nghiền nhỏ CaCO3.
Số biện pháp làm tăng tốc độ phản ứng là
Cho đồ thị biểu diễn đường cong động học của phản ứng giữa oxygen và hydrogen tạo thành nước như sau:
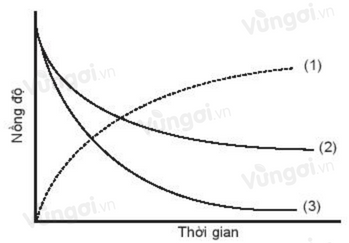
Đường cong nào là của oxygen?
Có hai mẫu đá vôi:
Mẫu 1: đá vôi có dạng khối.
Mẫu 2: đá vôi có dạng hạt nhỏ.
Hòa tan cả hai mẫu đá vôi bằng cùng một thể tích dung dịch HCl dư có cùng nồng độ. Ta thấy thời gian để mẫu 1 phản ứng hết nhiều hơn mẫu 2. Thí nghiệm trên chứng minh điều gì?
Cho phản ứng: Na2S2O3 (l) + H2SO4 (l) → Na2SO4 (l) + SO2 (k) + S (r) + H2O (l).
Khi thay đổi một trong các yếu tố: (1) tăng nhiệt độ; (2) tăng nồng độ Na2S2O3; (3) giảm nồng độ H2SO4; (4) giảm nồng độ Na2SO4; (5) giảm áp suất của SO2; (6) dùng chất xúc tác. Có bao nhiêu yếu tố làm tăng tốc độ của phản ứng đã cho?
Hai nhóm học sinh làm thí nghiệm nghiên cứu tốc độ phản ứng kẽm với dung dịch axit clohiđric:
• Nhóm thứ nhất: Cân 1 gam kẽm miếng và thả vào cốc đựng 200 ml dung dịch axit HCl 2M
• Nhóm thứ hai: Cân 1 gam kẽm bột và thả vào cốc đựng 300 ml dung dịch axit HCl 2M
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do:
Glucose là một loại monosaccarit với công thức phân tử C6H12O6 được tạo ra bởi thực vật và hầu hết các loại tỏa trong quá trình quang hợp từ H2O và CO2, sử dụng năng lượng từ ánh sáng mặt trời. Dung dịch glucose 5% (D=1,1 g/ml) là dung dịch đường tiêm tĩnh mạch, là loại thuốc thiết yếu, quan trọng của Tổ chức Y tế Thế giới (WHO) và hệ thống y tế cơ bản. Phương trình nhiệt hóa học của phản ứng oxi hóa glucose:
\({C_6}{H_{12}}{O_6}(s) + 6{O_2}(g) \to 6C{O_2}(g) + 6{H_2}O(l)\) \({\Delta _r}H_{298}^0 = - 2803,0kJ\)
Năng lượng tối đa khi một người bệnh được truyền 1 chai 250 ml dung dịch glucose 5% là
Để làm nóng khẩu phần ăn, người ta dùng phản ứng giữa CaO với H2O:
\(CaO(s) + {H_2}O(l) \to Ca{(OH)_2}(aq)\) \(\Delta H = - 105kJ\)
Giả thiết nhiệt lượng của phản ứng tỏa ra được dung dịch hấp thụ hết, nhiệt dung của dung dịch loãng bằng nhiệt dung của nước là 4,2J/g.K. Cần cho bao nhiêu gam CaO vào 200 gam H2O để nâng nhiệt độ từ 25oC lên 80oC?
Rót 100 ml dung dịch HCl 0,5M ở 25oC vào 100 ml dung dịch NaHCO3 0,5M ở 26oC. Biết nhiệt dung của dung dịch loãng bằng nhiệt dung của nước là 4,2 J/g.K và nhiệt tạo thành của các chất được cho trong bảng sau:
| Chất | HCl (aq) | NaHCO3 (aq) | NaCl (aq) | H2O (l) | CO2 (g) |
| \({\Delta _f}H(kJ/mol)\) | -168 | -932 | -407 | -286 | -392 |
Sau phản ứng, dung dịch thu được có nhiệt độ là
Tiến hành quá trình ozone hóa 100 g oxi theo phản ứng sau:
\(3{O_2}(g) \to 2{O_3}(g)\)
Hỗn hợp thu được có chứa 30% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tao thành của ozone (kJ/mol) có giá trị là
Cho phản ứng đốt cháy methane và acetylene:
\(C{H_4}(g) + 2{O_2}(g) \to C{O_2}(g) + 2{H_2}O(l)\) \({\Delta _r}H_{298}^0 = - 890,36kJ\)
\({C_2}{H_2}(g) + 2,5{O_2}(g) \to 2C{O_2}(g) + {H_2}O(l)\) \({\Delta _r}H_{298}^0 = - 1299,58kJ\)
Tại sao trong thực tế, người ta sử dụng acetylene trong đèn xì hàn, cắt kim loại mà không dùng methane?
Một phản ứng đơn giản xảy ra trong bình kín: 2NO (k) + O2 (k) \( \rightleftarrows \) 2NO2 (k). Giữ nguyên nhiệt độ, nén hỗn hợp phản ứng xuống còn 1/3 thể tích. Kết luận nào sau đây không đúng ?
Biết rằng khi nhiệt độ tăng lên 10oC thì tốc độ của một phản ứng tăng lên 3 lần. Tốc độ phản ứng đó tăng lên bao nhiêu lần khi tăng nhiệt độ từ 20oC lên 70oC?
Xét phản ứng sau:
\(2Cl{O_2} + 2NaOH \to NaCl{O_3} + NaCl{O_2} + {H_2}O\)
Tốc độ phản ứng được viết như sau: \(v = k.C_{Cl{O_2}}^a.C_{NaOH}^b\)
Thực hiện phản ứng với những nồng độ chất đầu khác nhau và đo tốc độ phản ứng tương ứng thu được kết quả trong bảng sau:
| STT | Nồng độ ClO2 (M) | Nồng độ NaOH (M) | Tốc độ phản ứng (mol/l.s) |
| 1 | 0,01 | 0,01 | 2.10-4 |
| 2 | 0,02 | 0,01 | 8.10-4 |
| 3 | 0,01 | 0,02 | 4.10-4 |
Tổng a + b bằng
Cho phương trình hóa học của phản ứng tổng hợp lưu huỳnh trioxit:
2SO2(k) + O2(k) ⇄ 2SO3(k)
Khi tăng nồng độ của O2 lên 2 lần và giảm nồng độ SO2 đi 2 lần thì tốc độ phản ứng thuận sẽ
Cho phản ứng hóa học sau : 2H2O2 (l) $\xrightarrow{{Mn{O_2}}}$ 2H2O(l) + O2 (k). Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng trên ?
Đổ một lượng dung dịch H2SO4 vào cốc đựng dung dịch Na2S2O3 được 40 ml dung dịch X. Nồng độ ban đầu của H2SO4 trong dung dịch X bằng 0,05M. Sau 20 giây quan sát phản ứng, thấy nồng độ H2SO4 chỉ còn 15% so với ban đầu và trong cốc xuất hiện m gam kết tủa vàng. Tốc độ trung bình của phản ứng trong 20 giây quan sát (tính theo H2SO4) và giá trị của m lần lượt là

