Cho 10,8 gam bột Al và m gam hỗn hợp X gồm CuO và Fe3O4 vào bình chân không rồi nung nóng, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau. Phần một cho tác dụng với dung dịch NaOH dư thấy thoát ra 0,06 mol khí H2, đồng thời thu được 18,08 gam hỗn hợp chất rắn không tan. Phần hai cho tác dụng hết với dung dịch HNO3 dư, thu được dung dịch Z chứa 106,16 gam muối và thoát ra 0,18 mol khí NO duy nhất. Khối lượng Fe3O4 có trong m gam X là
Trả lời bởi giáo viên
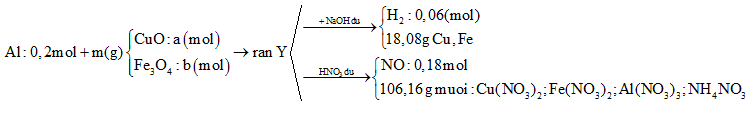
Coi trong mỗi phần có 0,2 mol Al
- Rắn Y + NaOH → 0,06 mol H2
BT: e => nAl dư \(=\frac{2}{3}.{{n}_{{{H}_{2}}}}=\frac{2}{3}.0,06=0,04\text{ (mol)}\)
BTNT: Al => nAl2O3 = ½.( nAl bđ – nAl dư) = ½.(0,2 – 0,04) = 0,08 (mol)
BTKL: m = mFe, Cu + mO = 18,08 + 0,08.3.16 = 21,92 (g)
=> 80a + 232b = 21,92 (1)
- Rắn Y + HNO3
Sau tất cả quá trình ta có: Al → Al+3 ; Fe+8/3 → Fe+3, N+5 → N+2; N+5→ N-3
BT e ta có: \(3{{n}_{Al}}~+{{n}_{F{{e}_{3}}{{O}_{4}}}}~=3{{n}_{NO}}+8{{n}_{N{{H}_{4}}N{{O}_{3}}}}\)
\(=>{{n}_{N{{H}_{4}}N{{O}_{3}}}}=\frac{0,2.3+b-0,18.3}{8}=\frac{b+0,06}{8}\)
mmuối \(={{m}_{Al{{\left( N{{O}_{3}} \right)}_{3}}}}+{{m}_{Cu{{\left( N{{O}_{3}} \right)}_{2}}}}+{{m}_{Fe{{\left( N{{O}_{3}} \right)}_{3}}}}~+{{m}_{N{{H}_{4}}N{{O}_{3}}}}\)
=> \(213.0,2+188a+242.3b+80.\frac{b+0,06}{8}=106,16\text{ }\left( 2 \right)\)
Từ (1) và (2) => a = 0,1 và b = 0,06
=> mFe3O4 = 232.2b = 232.2.0,1= 27,84 (g) (Vì hỗn hợp ban đầu nên phải nhân đôi số liệu)
Hướng dẫn giải:
Tóm tắt sơ đồ bài toán:
Coi trong mỗi phần có 0,2 mol Al
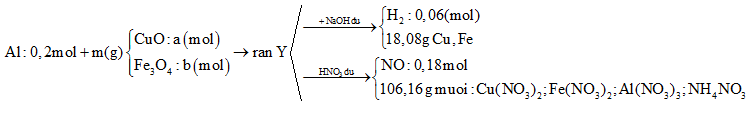
Dùng bảo toàn e, bảo toàn nguyên tố, bảo toàn khối lượng