Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch hỗn hợp gồm H2SO4 và Al2(SO4)3. Sự phụ thuộc của khối lượng kết tủa (y gam) vào số mol Ba(OH)2 (x mol) được biểu diễn bằng đồ thị dưới đây:
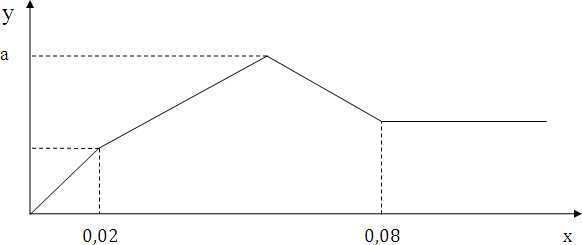
Giá trị của a là
Trả lời bởi giáo viên
Đặt số mol H2SO4 = u (mol) ; số mol Al2(SO4)3 = v (mol)
→ hỗn hợp ban đầu chứa: \({n_{{H^ + }}} = 2u\,\,mol;{n_{A{l^{3 + }}}} = 2v\,\,mol;{n_{SO_4^{2 - }}} = u + 3v\,\,mol\)
Tại \({n_{Ba{{(OH)}_2}}}\) = 0,02 (mol) → H2SO4 trung hòa hết
→ \({n_{{H_2}S{O_4}}}\) = \({n_{Ba{{(OH)}_2}}}\) = 0,02 (mol) = u
Tại \({n_{Ba{{(OH)}_2}}}\) = 0,08 (mol) thì Al(OH)3 bị hòa tan hoàn toàn, kết tủa thu được chỉ chứa BaSO4
→ \({n_{O{H^ - }}} = {n_{{H^ + }}} + 4{n_{A{l^{3 + }}}}\)
→ 2.0,08 = 2.0,02 + 4.2v
→ v = 0,015 (mol)
→ \({n_{Al{{(OH)}_3}\,\,\max }} = {n_{A{l^{3 + }}}}\) = 2v = 0,03 (mol)
→ \({n_{BaS{O_4}}} = {n_{SO_4^{2 - }}}\) = u + 3v = 0,02 +3.0,015 = 0,065 (mol)
\(a = {m_{BaS{O_4}\,\,\max }} + {m_{Al{{(OH)}_3}\,\,m{\text{ax}}}} = 233(u + 3v) + 78.2v\) = 0,065.233 + 0,03.78 = 17,485 (g)
Hướng dẫn giải:
Đặt số mol H2SO4 = u (mol) ; số mol Al2(SO4)3 = v (mol)
Tại \({n_{Ba{{(OH)}_2}}}\) = 0,02 (mol) → H2SO4 trung hòa hết → \({n_{{H_2}S{O_4}}} = {n_{Ba{{(OH)}_2}}} = u\)
Tại \({n_{Ba{{(OH)}_2}}}\) = 0,08 (mol) thì Al(OH)3 bị hòa tan hoàn toàn, kết tủa thu được chỉ chứa BaSO4
→ \({n_{O{H^ - }}} = {n_{{H^ + }}} + 4{n_{A{l^{3 + }}}} \to v\)
\(a = {m_{BaS{O_4}\,\,\max }} + {m_{Al{{(OH)}_3}\,\,m{\text{ax}}}} = 233(u + 3v) + 78.2v\)