Cho hỗn hợp chất rắn gồm CaC2, Al4C3, Ca vào nước dư thu được hỗn hợp X gồm 3 khí (trong đó có 2 khí có cùng số mol). Lấy 8,96 lít hỗn hợp X (đktc) chia làm 2 phần bằng nhau. Phần 1 cho vào dung dịch AgNO3 trong NH3 (dư), sau phản ứng thu được 24 gam kết tủa. Phần 2 cho qua Ni (đun nóng) thu được hỗn hợp Y. Thể tích O2 (đktc) cần dùng để đốt cháy hoàn toàn Y là
Trả lời bởi giáo viên
CaC2, Al4C3, Ca tác dụng với H2O thu được hỗn hợp X gồm 3 khí lần lượt là C2H2; CH4 và H2.
nX = 8,96/22,4 = 0,4 (mol) ⟹ nX trong mỗi phần = 0,2 (mol)
Phần 1: Chỉ có C2H2 pư
PTHH: C2H2 + AgNO3 + NH3 → Ag2C2↓ + NH4NO3
⟹ nC2H2 = nAg2C2 = 24/240 = 0,1 (mol)
⟹ (nCH4 + nH2) = nX - nC2H2 = 0,2 - 0,1 = 0,1 (mol)
Hỗn hợp X có 2 khí có số mol bằng nhau ⟹ nCH4 = nH2 = 0,1/2 = 0,05 (mol) (vì nếu C2H2 bằng với mol 1 chất khí còn lại thì vô lí).
Phần 2: Thành phần nguyên tố của hỗn hợp X và Y giống nhau nên đốt Y cũng như đốt X.
\(\left\{ \begin{array}{l}{C_2}{H_2}:0,1\\C{H_4}:0,05\\{H_2}:0,05\end{array} \right. + {O_2} \to \left\{ \begin{array}{l}C{O_2}:0,25\left( {BTNT.C} \right)\\{H_2}O:0,25\left( {BTNT.H} \right)\end{array} \right.\)
BTNT.O ⟹ nO2 pư = nCO2 + ½ nH2O = 0,25 + ½.0,25 = 0,375 mol
⟹ VO2 (đktc) = 0,375.22,4 = 8,4 (lít).
Hướng dẫn giải:
CaC2, Al4C3, Ca tác dụng với H2O thu được hỗn hợp X gồm 3 khí lần lượt là C2H2; CH4 và H2.
Phần 1: Chỉ có C2H2 pư
PTHH: C2H2 + AgNO3 + NH3 → Ag2C2↓ + NH4NO3
Từ số mol kết tủa Ag2C2 suy ra số mol C2H2.
Hỗn hợp X có 2 khí có số mol bằng nhau ⟹ nCH4 = nH2.
Phần 2: Thành phần nguyên tố của hỗn hợp X và Y giống nhau nên đốt Y cũng như đốt X.
\(\left\{ \begin{array}{l}{C_2}{H_2}\\C{H_4}\\{H_2}\end{array} \right. + {O_2} \to \left\{ \begin{array}{l}C{O_2}\\{H_2}O\end{array} \right.\)
BTNT.C ⟹ nCO2 = 2nC2H2 + nCH4
BTNT.H ⟹ nH2O = nC2H2 + 2nCH4 + nH2
BTNT.O ⟹ nO2 pư = nCO2 + ½ nH2O ⟹ VO2 (đktc).

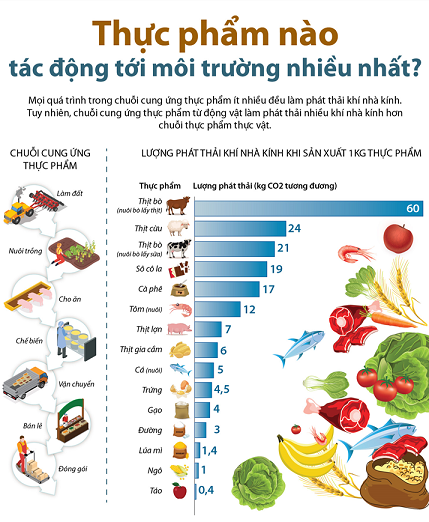 (Nguồn: ourwordindata.org)
(Nguồn: ourwordindata.org)